Можливості корекції постковідного синдрому в рутинній клінічній практиці
Публікацію оновлено: Липень 19
Коронавірусна хвороба 2019 (COVID‑19) — це інфекційне гостре респіраторне захворювання, спричинене новим коронавірусом, від якого постраждало населення понад 200 країн світу. 31 грудня 2019 року до Всесвітньої організації охорони здоров’я (ВООЗ) надійшла інформація про зафіксовані випадки пневмонії неясної етіології в місті Ухань, Китай [1]. Згодом ВООЗ повідомила, що в зразках, відібраних у хворих пацієнтів, був виявлений новий тип коронавірусу — SARS-CoV-2 (severe acute respiratory syndrome-related coronavirus 2). Враховуючи стрімке поширення цього захворювання, з 30 січня 2020 року ВООЗ оголосила надзвичайну ситуацію, а з 11 березня 2020 року COVID‑19 офіційно було визнано пандемією. Задля обмеження поширення SARS-CoV-2 серед населення багато країн прореагували заходами фізичного дистанціювання, реорганізацією систем охорони здоров’я, нормами блокування та планами дій на випадок непередбачених ситуацій [2].
Поряд із класичними проявами SARS-CoV-2 — лихоманкою, сухим кашлем і задишкою, в інфікованих хворих виявляють і незвичні симптоми — дерматологічні, шлунково-кишкові, неврологічні та кардіологічні [3].
Наявність супутніх захворювань, таких як хронічне обструктивне захворювання легень, серцево-судинні захворювання (гіпертонічна хвороба, серцева недостатність), хвороби нирок і порушення обміну речовин (цукровий діабет, ожиріння, метаболічний синдром), є однією з основних причин смертності та тяжкого перебігу у хворих на COVID‑19. Це зумовлено підвищеною периферичною гіпоксичною хіміочутливістю, яка є одним з основних механізмів активації симпатичної нервової системи при зазначених вище захворюваннях. Є дані, що у 20-40% госпіталізованих хворих із COVID‑19 було виявлено ураження міокарда. Повідомлялось також про випадки синдрому Такоцубо. При цьому виді стресової кардіоміопатії, яка розвивається на тлі активації симпатичної нервової системи, міокард, імовірно, опосередковано пошкоджується індукованим катехоламінами спазмом судин та/або безпосередньою дією катехоламінів на міоцити. Вважається, що вивільнення катехоламінів у відповідь на цитокіновий шторм, метаболічний та емоційний дистрес відіграють певну роль у виникненні синдрому Такоцубо на тлі COVID‑19. Також у дослідженні, проведеному Wang і співавт. (2020), 7,2% пацієнтів мали або підвищені рівні тропоніну, або нові порушення на електрокардіограмі/ ехокардіограмі, що свідчать про пошкодження серця [4, 5].
Натепер перед сучасною медичною спільнотою, окрім власне захворювання COVID‑19, постала нова проблема — так звана «епоха» постковідного синдрому, яка є надзвичайно актуальною та потребує подальших досліджень [6].
Керівництво NICE (the National Institute for Clinical Excellence), опубліковане 30 жовтня 2020 року, визначає постковідний синдром як суму ознак та симптомів, що розвиваються під час або після інфекції COVID‑19 та які тривають понад 12 тижнів і не пояснюються альтернативним діагнозом. Це визначення характеризує постковідний синдром як стан, який має сукупність симптомів, що часто перекриваються і можуть змінюватися з часом та впливати на будь-яку систему в організмі [7].
Сьогодні експерти намагаються знайти відповіді щодо цього стану. Низка досліджень продемонстрували те, що лише в 10% людей із COVID‑19 розвивається постковідний синдром, тоді як інші дослідження демонструють набагато більший відсоток — деякі навіть припускають, що до 70% людей відчувають стійкі симптоми. Окрім того, встановлено, що навіть легкий перебіг COVID‑19 може мати досить вагомі симптоми, включаючи виснажливі головні болі, сильну втому й крепатуру в тілі, через які неможливо почуватись комфортно. До найпоширеніших симптомів перенесеного COVID‑19 відносять: втому, утруднене дихання, генералізований біль, біль у грудях, психічні розлади, нездатність зосередитися та порушення пам’яті, відчуття занепокоєння, втрату смаку та/ або запаху, проблеми зі сном [8].
Згодом NICE видав офіційний протокол із рекомендаціями щодо виявлення, діагностики та реабілітації пацієнтів із постковідним синдромом. Цей протокол містить рекомендації щодо оцінки ключових сфер, серед яких: аналіз пацієнтів з уперше виявленим чи тривалим постковідним синдромом; діагностика та направлення; планування спостереження за цією групою пацієнтів; управління, включаючи самоуправління, підтримане самоврядування та реабілітацію; подальше спостереження та моніторинг; організація обслуговування. Для посилення підтримки пацієнтів із постковідним синдромом розроблено п’ять частин пакета заходів. Пакет заходів передбачає цифрову, інтерактивну та спеціально налаштовану програму відновлення й реабілітації, розроблену експертами для надання реабілітаційної допомоги пацієнтам із постковідним синдромом для забезпечення оптимального та швидкого одужання вдома [9].
Таким чином, на перше місце виходить вивчення патогенезу SARS-CoV-2 на організм людини загалом та на органи й системи зокрема. Розуміння впливу, у свою чергу, допоможе проведенню ефективного лікування та реабілітації пацієнтів із постковідним синдромом. На сьогодні точний механізм залучення серцево-судинної системи при COVID‑19 ще не зовсім зрозумілий, проте є дані, що клітини, які експресують рецептори ангіотензинперетворюючого фактора 2 (AПФ2), потенційно схильні до ризику інфікування SARS-CoV-2 [4, 10]. АПФ2, виступаючи рецептором коронавірусів SARS-CoV-2 та SARS-CoV, є ключовою ланкою ренін-ангіотензинової системи, що робить внесок у патофізіологію захворювань серцево-судинної, ендокринної, видільної систем. АПФ2, що в нормі діє як протеаза для розщеплення ангіотензину II, підтримує показники артеріального тиску, частоти серцевих скорочень й осмотичного тиску [9, 10]. Плейотропні ефекти гена АПФ2 актуалізують аналіз накопичених генетичних і епідеміологічних даних щодо SARS-CoV-2, COVID‑19 і мультифакторіальних патологій людини.
Отже, у пацієнтів із високим ризиком розвитку серцево-судинних захворювань втрата AПФ2 в результаті інтерналізації рецепторів, викликаної SARS-CoV 2, загострить серцево-судинне захворювання (ССЗ).
Зниження експресії рецепторів АПФ2 в судинній стінці сприяє розвитку ендотеліальної дисфункції й запалення, особливо при таких супутніх захворюваннях, як атеросклероз і діабет. При розвитку ендотеліальної дисфункції відбувається порушення балансу вазоконстрикторних і вазодилатуючих факторів: ендотелій починає працювати на користь зменшення вазодилатації, а також провокує розвиток запальних процесів і тромбоутворення [4]. Зазвичай таке порушення роботи ендотелію супроводжується порушенням коагуляції, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції, при цьому також посилюється вивільнення інгібітора активатора плазміногену 1-го типу, фактора Віллебранда. Одним з основних медіаторів судинного ендотелію, який має вазодилатуючу дію, зменшує адгезію тромбоцитів і лейкоцитів, є оксид азоту (NO). NO здатний змінювати діаметр судин різного калібру, забезпечує їх розширення й поліпшення мікроциркуляції. При ендотеліальній дисфункції відбувається значне зниження продукції NO, що призводить до переважання дії вазоконстрикторів, тромбоксану А2, серотоніну; крім того, значно посилюється адгезія тромбоцитів.
При пошкодженні ендотелію в результаті вірусного впливу на тканини легень відбувається зниження продукції NO внаслідок посиленого його руйнування через дію вільних радикалів, зниження доступності попередника NO — L-аргініну, ендотелій-залежної вазодилатації [4, 11]. L-аргінін є частково замінною амінокислотою, з якої під впливом NO-синтетази ендотелію продукується NO. Екзогенне надходження L-аргініну як субстрату для синтезу NO є патогенетично обґрунтованим шляхом зменшення проявів ендотеліальної дисфункції.
Цитокіновий шторм через системне запалення та гіпоксичний стан (унаслідок гострого респіраторного дистрес-синдрому — ГРДС), які викликають підвищення рівня позаклітинного кальцію, що призводить до апоптозу міоцитів, також є можливим механізмом ушкодження. Крім того, у пацієнтів відзначається серцебиття через аритмію. Тип аритмій мінливий, а етіологія може бути багатофакторною, починаючи від гіпоксичного стану, викликаного ГРДС, і закінчуючи міокардитом. Також повідомлялося про пацієнтів зі зниженою фракцією викиду та збільшенням серця. Отже, усе зазначене вище необхідно розглядати як можливість подальшого довготривалого впливу COVID‑19 на серцево-судинну систему в гострий період хвороби та при перебігу постковідного синдрому.
Поширеності неврологічних розладів у пацієнтів із COVID‑19 присвячені також масштабніші дослідження, проведені в уражених пандемією Китаї та Франції. Було доведено, що в 36% осіб із коронавірусною інфекцією виявлені неврологічні симптоми. У більшості хворих вони були легкими, мали місце скарги на головний біль, запаморочення, рідше траплялися більш специфічні та тяжкі прояви, як-то втрата нюху чи смаку, м’язова слабкість, інсульти, судоми та галюцинації [12]. У разі тяжкого перебігу коронавірусної хвороби неврологічні симптоми спостерігалися в 46-84% випадків. До того ж були описані порушення свідомості, рухових функцій і позної регуляції, дезорієнтація, неуважність, та виявлено, що вони зберігалися після одужання [13, 14].
Було висунуто припущення, що вірусна інвазія ЦНС SARS-CoV2 можлива за допомогою синапс- пов’язаного шляху, який є характерним для інших коронавірусів, таких як SARS-CoV, і може призвести до неврологічних ускладнень, включаючи атаксію, судоми, невралгію, втрату свідомості, гострі цереброваскулярні захворювання та енцефалопатію. Mao L. еt al. (2020) повідомили, що в 36,4% їх когорти були неврологічні прояви, причому у важких пацієнтів були гострі цереброваскулярні захворювання, порушення свідомості та пошкодження скелетних м’язів [15].
Установлено, що коронавіруси HCoV є нейроінвазивними та нейротропними і можуть спричиняти надмірну активацію імунної системи, частково беручи участь в активації автоімунних реакцій до нейронів мозку, та викликати енцефаліт у чутливих пацієнтів. Окрім того, було показано, що в мишачій центральній нервовій системі нейрони — основна мішень інфекції, яка призводила до їхньої дегенерації та подальшої загибелі. Доведено, що глікопротеїн (S) вірусної поверхні є важливим фактором нейродегенеративного процесу [16].
Протягом багатьох років дослідники вже були обізнані про несприятливий вплив соціальної ізоляції на психічне здоров’я, частоту органних патологій, таких як ішемічна хвороба серця та інсульт, і ризик смертності. Але COVID‑19 викликав найбільшу насильницьку ізоляцію в історії людства. Тому прогнозувати, яке значення це матиме для психічного здоров’я, надзвичайно важко [17-20].
Пандемія COVID‑19 викликала зростання рівня тривоги й депресії в суспільстві. Особи із психічними розладами часто реагують на ситуацію хронічної фрустрації, депресивну налаштованість родичів та оточення, панічні настрої в суспільстві, що поширюються засобами масової інформації, появою чи посиленням тривоги й страхів. Це може призвести до рецидивів і загострень психотичних захворювань, самоушкоджувальної та суїцидальної поведінки [21].
Пацієнти з підтвердженим діагнозом COVID‑19 часто мають такі симптоми, як співчуття й образа, самотність і безпорадність, депресія, неспокій і фобія, роздратування та недосипання. У деяких пацієнтів можуть бути напади паніки. Психологічні дослідження в ізольованих відділеннях показали, що в близько 48% пацієнтів із підтвердженим COVID‑19 при ранньому надходженні проявлявся психологічний стрес — у більшості випадків у вигляді емоційної реакції на стрес [22].
Окрім того, низка учених (Yao H., Chen J.H., Xu Y.F., 2020) висловили своє занепокоєння й думку щодо впливу психічних розладів на зростання поширення коронавірусного захворювання. Підвищену ймовірність зараження пов’язують із когнітивними порушеннями в дефектних хворих, недостатньою обізнаністю пацієнтів про ризик інфікування, нездатністю дотримуватися гігієнічних правил, браком зусиль щодо особистого захисту, а також скупченістю хворих у психіатричних відділеннях та інтернатах [23].
Тобто, важливе місце в лікуванні постковідного синдрому посідають препарати, які впливають на ендотелій і ЦНС.
Одним із таких препаратів, здатних забезпечити спрямовану патогенетичну фармакотерапію постковідного синдрому, є Мілдрокард-Н (мельдоній — 3-(2,2,2-триметилгідразиній) пропіонат). Він є одним з оборотних інгібіторів гамма-бутиробетаїну в карнітин. Препарат знижує карнітин- залежний транспорт жирних кислот у мітохондрії м’язової тканини, зменшує інтенсивність перекисного окислення ліпідів і підвищує активність ендогенних антиоксидантів, нівелюючи наслідки окисного стресу; підвищує чутливість до інсуліну, змінює метаболізм глюкози і ліпідів. Спектр антиоксидантних ефектів мельдонію включає активацію природної антиоксидантної системи організму (ферменти супероксиддисмутази, каталази); інгібування вільнорадикального окислення ліпідів за рахунок зниження карнітин-залежного окислення жирних кислот і стимулювання утворення оксиду азоту шляхом підвищення концентрації гамма-бутиробетаїну й NO-залежного зв’язування вільних радикалів. Мілдрокард-Н діє і як блокатор, і як пастка вільних радикалів, що забезпечує максимальну повноту реалізації його антиоксидантної дії [1-8]. Раніше проведені клінічні дослідження продемонстрували, що у хворих похилого віку з різними формами хронічної цереброваскулярної патології мельдоній зменшував периферичний опір судин, усував вазоспазм, поліпшував когнітивні функції [1, 3, 8]. У хворих із цукровим діабетом 2-го типу лікування мельдонієм дозволяло знизити дозу гіполіпідемічних і цукрознижувальних препаратів [15]. За даними досліджень, проведених у хворих з артеріальною гіпертензією, застосування мельдонію в поєднанні з базисною терапією сприяло зниженню рівня артеріального тиску, збільшенню числа осіб із цільовими рівнями АТ [9, 10]. У хворих зі стабільною стенокардією напруги (за даними міжнародних багатоцентрових рандомізованих подвійних сліпих плацебо-контрольованих клінічних досліджень МІЛСС I, МІЛСС II) препарат у поєднанні зі стандартною терапією приводив до зменшення числа нападів стенокардії, підвищував толерантність до фізичного навантаження, поліпшував якість життя [11, 13]. У дослідженнях за участю хворих із хронічною ІХС мельдоній приводив до збільшення фракції викиду лівого шлуночка, зменшення тиску в легеневій артерії, нормалізації варіабельності ритму серця [1-9]. Однак, незважаючи на різноманіття цих досліджень, даних при комплексному аналізі впливу мельдонію на функціональний стан центральної нервової та серцево-судинної систем не представлено.
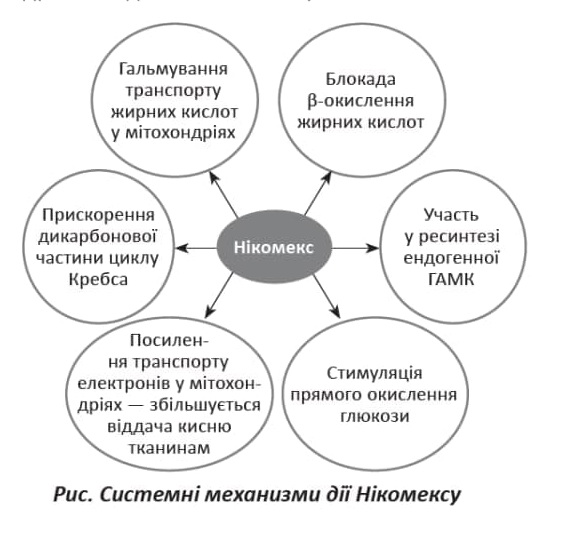
Враховуючи те, що патогенетичним механізмом развитку постковідного синдрому є порушення енергетичного метаболізму, застосування енергокоригуючих препаратів є патогенетично зумовленим. Цей ефект досягається шляхом використання сукцинатвмісних речовин, зокрема Нікомексу (етилметилгідроксипіридину сукцинат). Також слід відмітити широкий спектр дії Нікомексу, здатність інгібувати вільнорадикальне окислення ліпідів мембран та синтез тромбоксану А, лейкотрієнів, підвищувати активність ферментів, чинити гіполіпідемічну дію, знижувати інтенсивність ацидозу та активізувати метаболічні процеси (див. рис.).
Натепер доведено універсальність механізмів пошкодження нейронів при різних видах патологічних процесів, у тому числі й впливу етанолу. Кінцевою ланкою при запаленні, ішемії є порушення окисно-відновних процесів, метаболізму та енергетичного забезпечення клітин. Сьогодні нейротрофічність, нейропротекція, нейропластичність і нейрогенез розглядаються як фундаментальні нейробіологічні процеси, які беруть участь у реалізації ендогенного захисту від патофізіологічних ушкоджувальних механізмів і стимулюванні ендогенного відновлення. Нейропротекцію визначають як безперервну адаптацію нейрона до нових функціональних умов, як ключ до зменшення пошкоджень мозкової тканини, викликаних ішемією, вона діє на рівні молекулярного каскаду, що зумовлює дисфункцію і смерть нейронів (Brown E.S., Gorman A.R., Hynan L.S., 2007).
Як було зазначено вище, постковідний синдром — одна з основних причин летальності та стійкої втрати працездатності хворих. У клінічній практиці широко використовуються препарати, об’єднані в групу «нейропротектори». Цільовий вплив на ключові ланки процесів загибелі нервових клітин судинної, травматичної, токсичної та іншої етіології з групи нейропротекторів має цитиколін — природний ендогенний нуклеозид, що складається із цитидину і холіну, пов’язаних дифосфатним містком. Цитиколін бере участь у синтезі мембранних фосфоліпідів як проміжна ланка, він не тільки відновлює пошкоджені нейрональні мембрани, а також є донором холіну для синтезу ацетилхоліну (Plataras C., Taskiris S., Angelogianni P., 2000). Цитиколін також пригнічує синтез фосфоліпази А2, зменшуючи накопичення вільних жирних кислот, відновлює функціонування Na+/K+-АТФази, посилює активність антиоксидантних систем, перешкоджає процесам окислювального стресу та апоптозу, позитивно впливає на холінергічну передачу, модулює дофамін і глутаматергічну нейротрансмісію. Крім цього, цитиколін має виражений нейрорепаративний ефект, стимулюючи процеси нейро- та ангіогенезу (Secades J., 2011).
Утворення цитиколіну в мембранах нейронів і фосфоліпідів макросом є етапом, що лімітує швидкість у синтезі фосфатидилхоліну (лецитину). У цьому випадку цитиколін є донором холіну для синтезу ацетилхоліну й може обмежувати об’єм останнього. При окисленні утворюється бетаїн — донор метильних груп (Шавловський О.А., 2012). Цитиколін є природним метаболітом біохімічних процесів в організмі й поєднує у своєму спектрі нейромедіаторні і нейрометаболічні ефекти. Найважливішим із них є активація біосинтезу мембранних фосфоліпідів нейронів мозку, насамперед фосфатидилхоліну. Когнітивні порушення є ключовим проявом постковідного синдрому, що багато в чому визначає тяжкість стану хворих. На ранній стадії переважають помірні нейродинамічні порушення у вигляді сповільненості, аспонтанності, зниження працездатності, виснаження, ослаблення концентрації уваги. У деяких дослідженнях, присвячених діагностиці та принципам терапії когнітивних розладів при судинних захворюваннях головного мозку, подано обґрунтування призначення цитиколіну при помірних когнітивних розладах і деменції. Авторами робиться висновок, що позитивні ефекти цитиколіну впливають на всі етапи «ішемічного каскаду», а поєднання нейропротективного і нейрометаболічного впливу препарату зумовлює його здатність знижувати відкладення бета-амілоїду в головному мозку. При судинних захворюваннях головного мозку нерідко трапляється астенічний синдром у комплексі з іншими синдромами. У низці проведених досліджень була показана висока ефективність цитиколіну (як у вигляді монотерапії, так і в комплексній терапії) при лікуванні пацієнтів із гострою та хронічною ішемією мозку й пов’язаних із ними астенічних станів (Шавловський О.А., 2013). Також була продемонстрована ефективність терапії цитиколіном у пацієнтів із помірними когнітивними розладами при гострому порушенні мозкового кровообігу. Так, у пацієнтів, що приймали цитиколін, через 3 місяці було відзначено наростання сили в кінцівках, а через 6 місяців отримано достовірне поліпшення показників за шкалами, які оцінюють неврологічний дефіцит (регрес когнітивних порушень, емоційно-афективних і поведінкових розладів) (Путіліна М.В., 2009). Використання цитиколіну у відновлювальному періоді ішемічного інсульту у хворих із помірними когнітивними порушеннями (розлади пам’яті, уваги і мислення) приводило до поліпшення когнітивних функцій вже через 10 днів після початку терапії (Шахпаронова Н.В., Кадиків А.С., Кашина Е.М., 2011).
У низці проведених досліджень показана висока ефективність цитиколіну в профілактиці й терапії помірних когнітивних розладів судинного генезу (Шавловський О.А., 2013). Застосування цитиколіну сприяє регресу когнітивних порушень, зменшує супутні емоційно-афективні та поведінкові розлади. Крім того, цитиколін здатний підсилювати дію інших лікарських засобів при лікуванні гострої цереброваскулярної патології, у тому числі тромболітиків, антиагрегантів і нейротрофіків (Бойко А.М., Кабанов А.А., 2007).
Завдяки стабілізуючому впливу на мембрану цитиколін має протинабряковий ефект і попереджає розвиток набряку мозку, а шляхом придушення фосфоліпаз А1, А2, С-D зменшує утворення вільних радикалів і посилює антиоксидантні захисні системи. Вказані вище властивості препарату дозволяють рекомендувати цитиколін для включення в схему стандартної терапії пацієнтів із запамороченням центрального генезу судинної етіології (Petrova D., Maslarov D., Angelov I., Zekin D., 2012). Ефективність нейропротекції з використанням цитиколіну продовжує активно вивчатися як в експериментальній, так і клінічній практиці. На сьогодні цитиколін — єдиний із нейропротекторів, який входить до європейських рекомендацій щодо лікування інсульту (ESO).
У висновку слід зазначити, що на ринку України представлені препарати компанії Nikopharm, а саме Нікомекс (етилметилгідроксипіридину сукцинат), Мілдрокард-Н (мельдоній) і Фармаксон (цитиколін), властивості яких мають можливість допомогти в рутинній клінічній практиці для полегшення симптомів постковідного синдрому, пов’язаних із підвищеною активністю симпатичної нервової системи та ендотеліальною дисфункцією.
Список використаної літератури
-
Chen Y. Emergingcoronaviruses: Genomestructure, replication, andpathogenesis // J. Med. Virol. — 2020. — Vol. 92. — P. 418-423.
-
World Health Organisation. WHO Response in Countries [Електронний ресурс]. — Режим доступу: https://www.who.int/emergencies/diseases/ novel-coronavirus‑2019/donate/who-response-in-countries. Accessed 4. — May, 2020.
-
Aghagoli G., Gallo Marin B., Soliman L.B., Sellke F.W. Cardiac involvement in COVID‑19 patients: Risk factors, predictors, and complications: A review // J. Card. Surg. — 2020, Jun. — Vol. 35 (6). — P. 1302-1305. doi: 10.1111/jocs.14538. Режим доступу: https://doi.org/10.1111/jocs.14538
-
Кобилянський Ю.Ю. Особенности патогенеза коронавирусной инфекции и перспективные направления терапии [Електронний ресурс]. — Режим доступу: https://health-ua.com/article/60327-osobennosti-patogeneza-koronavirusnoj-infektcii-iperspektivnye-n...
-
Long B., Brady W.J., Koyfman A., Gottlieb M. Cardiovascular complications in COVID‑19 // Am. J. Emerg. Med. — 2020. — Vol. 38 (7). — P. 1504- 1507. doi:10.1016/j.ajem.2020.04.048https://bestpractice.bmj.com/topics/en-gb/3000201.
-
NICE, the Scottish Intercollegiate Guidelines Network (SIGN) and the Royal College of General Practitioners (RCGP) have today (30 October 2020) given more details about the forthcoming guideline on post-COVID syndrome. [Електронний ресурс]. — Режим доступу: https://www.nice.org. uk/news/article/nice-sign-and-rcgp-set-out-further-details-about-the-uk-guideline-on-management-of-the-long-term-effects-of-covid‑19
-
Post-COVID Syndrome: What Should You Do If You Have Lingering COVID‑19 Symptoms? [Електронний ресурс]. — Режим доступу: https:// www.houstonmethodist.org/blog/articles/2020/nov/post-covid-syndrome-what-should-you-do-if-you-have-l...
-
NICE, SIGN and RCGP set out further details about the UK guideline on management of the long-term effects of COVID‑19. [Електронний ресурс]. — Режим доступу: https://www.nice.org.uk/news/article/nice-sign-and-rcgp-set-out-further-details-about-the-uk-guideli...
-
South A.M., Diz D.I., Chappell M.C. COVID‑19, ACE2, and the cardiovascularc onsequences // Am. J. Physiol. Heart Circ. Physiol. Published. — 2020. — Vol. 318, No 5. [Електронний ресурс]. — Режим доступу: https://doi.org/10.1152/ajpheart.00217.2020
-
Корекція ендотеліальної дисфункції при ішемічній хворобі серця в поєднанні з цукровим діабетом / Н.В. Снігир [та ін.] // Ліки України. — 2016, № 3. — С. 53-56.
-
Mao L., Jin H., Wang M., Hu Y., Chen S., He Q. et al. Neurologic manifestations of hospitalized patients with coronavirus disease. — 2019 in Wuhan, China // JAMA, Neurology. — 2020.
-
Helms J., Kremer S., Merdji H., Clere-Jehl R., Schenck M., Kummerlen C. et al. Neurologic features in severe SARS-CoV-2 infection // N. Engl. J. Med. — 2020. — Vol. 382. — P. 2268-2270. doi: 10.1056/NEJMc2008597.
-
Марценковський І.А., Марценковська І.І., Здорик І.Ф. Проблеми охорони психічного здоров’я, зумовлені пандемією COVID‑19. [Електронний ресурс]. — Режим доступу: https://health-ua.com/article/60141-problemi-ohoroni-psihchnogo-zdorovya — zumovlen-pandemyu-COVID19
-
Desforges M., LeCoupanec A., Brison É., Meessen-Pinard M., Talbot P.J. Neuroinvasive and neurotropic human respiratory coronaviruses: potential neurovirulent agents in humans // In Infectious Diseasesand Nano medicine I. — 2014. — Р. 75-96. Режим доступу: https://health-ua.com/ article/60141-problemi-ohoroni-psihchnogo-zdorovya — zumovlen-pandemyu-COVID19
-
Valtorta N.K., Kanaan M., Gilbody S., Ronzi S., Hanratty B. Loneliness and social isolation as risk factors for coronary heart disease and stroke: systematic review and meta-analysis of longitudinal observational studies // Heart. — 2016. — Vol. 102 (13). — Р. 1009-1016.
-
Holt-Lunstad J., Smith T.B., Baker M., Harris T., Stephenson D. Loneliness and social isolation as risk factors for mortality: a meta-analytic review // Perspectives on Psychological Science. — 2015. — Vol. 10 (2). — Р. 227-237.
-
Brooks S.K., Webster R.K., Smith L.E. et al. The psychological impact of quarantine and how to reduce it: rapid review of the evidence // Lancet. — 2020. — Vol. 395 (10227). — Р. 912-920. doi:10.1016/S0140-6736(20)30460-8.
-
Yao H., Chen J.H., Xu Y.F. Patients with mental health disorders in the COVID‑19 epidemic // Lancet Psychiatry. — 2020. — Vol. 7 (4). — Р. e21. doi:10.1016/S2215-0366(20)30090-0