Вплив ресвератролу на оксидативний стрес як одну з мішеней терапії в пацієнтів із високим серцево-судинним ризиком
Публікацію оновлено: Липень 19
Термін «оксидативний стрес» було запроваджено в 1985 р. Н. Sies для опису порушень балансу АФК й антиоксидантів. Однак його визначення змінювалося протягом багатьох років через велику різноманітність результатів досліджень [1]. Сьогодні ОС – це стан, за якого порушується рівновага прооксидантної й антиоксидантної систем у клітині [2]. Концентрація АФК коливається контрольовано та зберігається завдяки антиоксидантам й іншим ферментам. Надлишок або недостатня утилізація АФК супроводжується їх накопиченням, що, своєю чергою, призводить до окисної модифікації ліпідів, білків і нуклеїнових кислот [3, 4]. Процес надлишкового ОС не лише зумовлює порушення функції, а й може призвести до смерті клітини. Головну роль у цьому механізмі надано АФК, які являють собою великі групи похідних вільнорадикальних процесів, включаючи супероксид-аніон (О2-), перекис водню (H2O2), гідроксильний радикал (–OH), гідропероксид (ROOH) [2, 5, 6].
Порушення балансу АФК, а саме збільшення їх продукції, призводить до пошкодження ДНК, білків і перекисного окислення ліпідів (ПОЛ). Такий стан характерний для хворих на ЦД та патологію серцево-судинної системи (ССС), яка набагато частіше трапляється в поєднанні з ЦД, ніж ізольовано [7].
Хоча не до кінця вивченими залишаються всі механізми, які беруть участь у патофізіології ССЗ, негативний вплив ОС на їхній генез є чітко з’ясованим. У різних наукових дослідженнях виявлено низку розбіжностей, які можуть бути зумовлені різними підходами, характеристиками зразків, дозами препаратів і методами їх застосування. Це потребує проведення масштабніших досліджень для визначення конкретних факторів, які беруть участь у стадіях розвитку ССЗ, опису надійних біомаркерів і механізмів впливу ОС із метою розроблення нових методів лікування та профілактики.
Серцево-судинні захворювання й оксидативний стрес
За даними Всесвітньої організації охорони здоров’я (ВООЗ), ССЗ є однією з основних причин передчасної смерті й інвалідності у світі. Розвиток ССЗ залежить як від модифікованих (рівень холестерину, маса тіла, куріння й артеріальний тиск – АТ), так і від немодифікованих (вік, стать, спадковість) факторів ризику [8].
Низка дослідників вважають, що до виникнення ОС призводять такі фактори серцево-судинного ризику, як ЦД, АГ, хвороби периферичних артерій, ожиріння, метаболічний синдром, дисліпідемія та куріння [4]. Натомість інші висловлюють думку, що на розвиток функціональних і структурних порушень ССС вказує формування ОС як наслідок підвищеного утворення АФК, зокрема супероксидного аніона, та недостатності механізмів антиоксидантного захисту. ОС та імунозапальні зміни, які є ланками патогенезу серцево-судинної дисфункції, можуть провокувати одне одного за принципом хибного кола [9]. Підвищений ОС у серці та кардіоміоцитах виникає через безліч механізмів, включаючи дисфункцію та роз’єднання мітохондрій, збільшення окислення жирних кислот, посилення активності нікотинамідаденіндинуклеотидфосфат (НАДФ)-оксидази та зниження антиоксидантної здатності.
Основним фактором ризику та головною причиною смерті населення України є АГ. Встановлено, що для АГ характерна виражена активація продукції вільних радикалів, а отже, формування стану ОС. Також доведено, що хворі на АГ мають підвищений рівень перекису водню в плазмі. Значне підвищення показника було відзначено в пацієнтів з АГ, у яких ця патологія спостерігалася в сім’ї. Крім того, в пацієнтів із генетичною схильністю до розвитку АГ, але з нормальними показниками рівня АТ вміст перекису водню в крові був значно вищим, аніж у пацієнтів без спадковості щодо АГ. Отже, при АГ структурні та функціональні зміни можуть бути зумовлені порушенням регуляції фізіологічних процесів, які виникають при утворенні реактивних видів кисню в усіх видах клітин. Надлишкове утворення супероксидного радикала ендотелієм, який є фізіологічним антагоністом окису азоту (NO), може призвести до вазоконстрикції. Тобто при АГ та високому АТ підвищується синтез NO як відповідь на механічні фактори: напруження зсуву, розтягнення судинної стінки, що є визначенням його компенсаторного значення. Існує припущення про наявність порогу АТ, вище якого відбувається порушення регуляції NO-синтази (NOS) і зрив компенсації NO-вазодилатації [3]. Слід зазначити, що одним з основних індукторів гіперпродукції супероксид-аніона є ангіотензин ІІ. Його дія може бути реалізована через активацію НАДФ-залежної мембранної оксидази. Відповідно, перекисна модифікація ангіотензинперетворювального ферменту підвищує його активність [9].
Доведено, що запальні процеси при АГ спричиняють ушкодження органів-мішеней. Цей вплив може здійснюватися через активацію генів, які контролюють вираженість запальних процесів. Маркерами генної чутливості до ОС при АГ є поліморфізм гена р22phox, а також активація генів-стимуляторів судинної НАДФ-оксидази [3].
Одним із найчастіших коморбідних станів, який має безпосередній вплив на величину глобального серцево-судинного ризику, є дисліпідемія [10]. Результати численних досліджень продемонстрували наявність прямого зв’язку між рівнем дисліпідемії та розвитком атеросклерозу.
Атеросклероз та оксидативний стрес
Атеросклероз – це хронічне захворювання стінок судин, яке пов’язане з ОС і дисфункцією ендотелію та характеризується асептичним запаленням, порушенням перфузії органів і тканин, схильністю до тромбоутворення та прогресуванням із віком дисфункції судинної стінки [11, 12].
Атеросклеротичний процес прискорюється безліччю факторів, як-от вивільнення запальних хемокінів і цитокінів, утворення АФК та факторів росту, проліферація непосмугованих м’язових клітин судин. Запалення й імунітет є ключовими факторами, які впливають на розвиток атеросклерозу та його ускладнень. ОС відіграє життєво важливу роль у прогресуванні патології. Атеросклеротичний процес починається з дисфункціональних змін ендотелію, що може призвести до активації ендотелію та тромбоцитів, адгезії моноцитів на активованому ендотелії та диференціації в прозапальні макрофаги, які збільшують поглинання окислених ліпопротеїнів низької щільності (ЛПНЩ) і перетворюються на пінисті клітини, посилюючи запальну сигналізацію [13]. При цьому утворюються вогнищеві скупчення холестерину, ліпідні плями, а потім і атеросклеротичні бляшки. Основним елементом атеросклеротичної бляшки є піниста клітина, руйнування котрої спричиняє проліферативну реакцію з боку гладком’язових клітин. Посилено синтезуються сполучнотканинні білки (еластин, колаген), утворюється так звана фіброзна бляшка. Фіброзні бляшки можуть збільшуватися за рахунок крововиливів у них, фібриноїдного просякання, нагромадження в них ліпідів, пристінкового тромбозу. У сформованій бляшці під впливом АФК руйнується сполучнотканинна капсула нестабільної атероми під дією ферментів металопротеаз. Ці ферменти є також наслідком модифікувальної дії АФК. Слід зазначити, що процес відбувається на тлі індукованої АФК дисфункції ендотелію з розвитком порушення вазодилатувальних властивостей артерій і посиленням патологічної форми апоптозу кардіоміоцитів [14].
Оскільки АФК є наслідком ОС і самі стимулюють формування супероксид-аніона, виникає хибне коло самовідтворення негативних факторів, які загрожують ССС [16].
Предіабет, цукровий діабет й оксидативний стрес
Предіабет – це стан підвищеного рівня глюкози в плазмі, який іще не досяг показників ЦД. Предіабет може перейти в ЦД 2 типу й також пов’язаний із розвитком ССЗ. Резистентність до інсуліну та порушення функції β-клітин часто наявні вже при предіабеті [12]. Світова захворюваність на ЦД рік у рік стрімко зростає. Це особливо важливо з огляду на те, що ЦД є важливим предиктором ССЗ і смертності. Популяційні дослідження продемонстрували, що 80% хворих на ЦД помирають від ССЗ [3]. ВООЗ прогнозує, що до 2030 р. щороку від ССЗ помиратиме 24 млн людей [8]. ЦД асоціюється з широким спектром ускладнень і пов’язаним із цим зниженням якості життя. Дослідження Framingham і MERIT демонструють, що в пацієнтів із ЦД у 2-4 рази частіше розвивається ССЗ і загальний рівень смертності втричі вищий порівняно з хворими без ЦД [3, 4, 17].
Характерними рисами ЦД є хронічна гіперглікемія, мікро та макросудинні ускладнення, хронічний запальний процес й ОС [18]. Низка дослідників вважають, що ОС відіграє особливу роль у розвитку ускладнень ЦД. ОС, який посилюється гіперглікемією, відіграє важливу роль в ушкодженні β-клітин острівців Лангерганса та прискорює прогресування ЦД. Доведено, що втрата β-клітин острівців Лангерганса характерна для ЦД 1 й 2 типів. Відомо, що ОС і запалення відіграють ключову роль у патогенезі та прогресуванні ССЗ, індукованого ЦД, за якого продемонстровано підвищену експресію запальних білків або цитокінів, як-от С-реактивний білок (СРБ). Отже, пов’язані з ОС білки можуть бути біомаркером для виникнення ССЗ і серцевої недостатності [19].
Маркерами ендотеліальної дисфункції при ЦД є активація ПОЛ, утворення модифікованих ліпопротеїнів і збільшення їхнього вмісту в пінистих клітинах [3]. Результатом модифікації окремих амінокислот є зміна антигенних властивостей білків, а ПОЛ призводить до утворення хемоатрактантів із подальшим посиленням міграції фагоцитів у вогнище запалення [10, 20, 21].
У пацієнтів із ЦД наявне порушення рівноваги між активністю ПОЛ і системою антиоксидантного захисту. Тобто швидкість ПОЛ перевищує можливість антиоксидантної системи «гасити» надлишкову кількість вільних радикалів. Водночас вільні радикали беруть участь у деструкції ендотелію, блокують синтез білка та нуклеїнових кислот, пригнічують гліколіз, що, своєю чергою, призводить до порушення функції багатьох тканин [22].
Отже, ОС при ЦД розвивається шляхом одразу декількох взаємозв’язаних процесів, включаючи активацію НАДФ-оксидаз, мітохондріальну дисфункцію та структурно-функціональні зміни NOS. Результатами ОС є альтерація ендотеліальних клітин і зниження вироблення NO, що призводить до порушення вазомоторної, бар’єрної, ангіогенної функцій ендотелію, а також його тромборезистентності [3].
Вважають, що ОС є головним фактором, який спричиняє розвиток і прогресування діабетичних ускладнень. Це також тісно пов’язано з резистентністю до інсуліну та порушенням його секреції, що призводить до розвитку ЦД. Отже, ОС при ЦД є важливим фактором, пов’язаним із розвитком не тільки діабетичних ускладнень, а й самого ЦД.
Своєчасне та правильне лікування гіперглікемії й гальмування надмірного продукування АФК є вирішальним для уповільнення розвитку ЦД та профілактики серцево-судинних ускладнень.
Віковий оксидативний стрес
Старіння та прискорене старіння – це не нові поняття, але вони стають дедалі актуальнішими в сучасному суспільстві. Триває пошук методів, які здатні сповільнити прогресування цього неминучого явища [3]. Епідеміологічні дослідження показали, що навіть за відсутності інших факторів ризику (ЦД, АГ, гіпергомоцистеїнемії, гіперхолестеринемії) похилий вік істотно збільшує серцево-судинну захворюваність через посилення судинного ОС і запалення [6, 14, 21]. При судинному старінні відзначається біологічна деградація клітин, яка пов’язана з раннім розвитком атеросклерозу. Сьогодні одними з індикаторів розвитку атеросклерозу є дефекти програмування смерті клітин (апоптозу) й посилення процесів окислення ліпідів, які спричиняють прогресування мультифокального атерогенезу [23]. Варто зауважити, що ОС реалізується за умови як нестачі, так і надлишку кисню й розвивається в перші години ішемії [6]. Зазвичай багаторазовий вплив реактивного кисню та NO спричиняє пошкодження клітин і, як наслідок, прозапальну реакцію сигналізації. ОС спонукає до вивільнення фактора некрозу пухлини (TNF) із пошкоджених клітин [24]. Зв’язування TNF із поверхневими рецепторами клітин активізує ядерний фактор каппа В (NF-κB), що призводить до подальшого продукування інших прозапальних цитокінів, особливо інтерлейкіну‑1β (IL‑1β). Посилення регуляції запалення за допомогою NF-κB – це, мабуть, головний етіологічний механізм для вікових хронічних станів із компонентом запального процесу. Підвищена концентрація ОС через функції імунних клітин, а також наслідки пошкодження клітин призводять до посилення метаболізму в навколишніх здорових тканинах.
Одним із наслідків ОС на молекулярному рівні є ушкодження нуклеїнових кислот. Сьогодні найвивченішим окислювачем ДНК вважається 8-ОН-дезоксигуанозин, який розглядають як біомаркер ОС через чутливість його вимірювань. Поряд із цим ознаками клітинного старіння вважається феномен передчасного старіння з проявами нейрокогнітивного дефіциту в осіб похилого віку. Основними причинами цього є атеросклероз сонних артерій, інсульт, атеросклеротичне ураження артерій інтракраніального відділу [23].
Ресвератрол у корекції ОС за серцево-судинної патології та ЦД
Ресвератрол – це природний фітоалексин, який має антиоксиданті, протизапальні, антиагрегантні й інші властивості, за допомогою котрих можна зупинити чи сповільнити прогресування ССЗ у пацієнтів високого ризику [24].
В якості захисної молекули, ресвератрол утворюється в рослинах під дією екологічних стресів – мікробної (грибкової) інфекції або ультрафіолетового опромінення [25]. Цю речовину виявлено в понад 70 видів рослин, включаючи шовковицю, евкаліпт, арахіс тощо. Найбільшу кількість ресвератролу містить шкірка винограду – від 50 до 100 мкг на 1 г, а в червоному вині так званого великого винного сорту з винограду Піно-нуар концентрація ресвератролу коливається від 0,1 до 14 мг на 1 л [24, 26, 27].
Порівняно високий вміст ресвератролу в червоному вині є поясненням терміна «французький парадокс», який уперше використали в інформаційному бюлетені Міжнародної організації винограду та вина в 1986 р. Було зазначено, що низький рівень захворюваності на атеросклероз коронарних судин зумовлений помірним споживанням червоного вина. У 1991 р. Серж Рено, французький вчений із Бордоського університету, здійснив низку досліджень, які рішуче підтвердили результат [28-30].
Потенційні механізми дії ресвератролу на організм людини численні. Велика кількість рецепторів, кіназ та інших ферментів взаємодіє з ресвератролом і певним чином впливає на зниження активності ОС [31]. Експерименти продемонстрували здатність ресвератролу безпосередньо відбирати гідроксильні та супероксидні радикали, що утворюються в результаті гамма-радіолізу води. Пригнічення радикалів ресвератролом супроводжувалося пригніченням ПОЛ [31, 34, 35].
Експерименти на клітинних культурах для вивчення впливу ресвератролу на зміни метаболічного синдрому, особливо в разі високої концентрації глюкози чи прозапальних цитокінів, показують зниження рівня АФК у багатьох типах клітин, у тому числі в ендотеліальних клітинах судин, адипоцитах, моноцитах і кардіоміоцитах [40-43]. У щурів з ожирінням та/або ЦД зменшення ОС на тлі прийому ресвератролу супроводжується зниженням запалення, гіперглікемії та резистентності до інсуліну, діабетичної нефропатії, накопичення жирової маси, стеатозу печінки, гіпертригліцеридемії, гіперхолестеринемії, ендотеліальної дисфункції й АГ [44-51].
Антиоксидантні властивості ресвератролу забезпечують зменшення окиснення ЛПНЩ (процес, який безпосередньо бере участь у атерогенезі) й індукції декількох ендогенних антиоксидантних систем [55]. Ресвератрол також пригнічує міграцію та проліферацію клітин непосмугованої мускулатури судинної стінки [56].
Одним із механізмів дії ресвератролу є його здатність підвищувати регуляцію eNOS, що поліпшує біодоступність NO [32]. Фізіологічна роль NO полягає в розширенні судин і зменшенні агрегації тромбоцитів, рекрутингу лейкоцитів і проліферації гладком’язових клітин, що, своєю чергою, пригнічує формування та прогресування атеросклерозу [8]. Експерименти in vitro за наявності високих концентрацій глюкози опосередковано показали потенційну користь ресвератролу на функцію ендотелію за рахунок поліпшення біодоступності NO [31, 32].
Ресвератрол сприяє зменшенню апоптозу й активації ендотелію, нівелюванню запалення судинної стінки [57]. Ця речовина має властивість протидіяти утворенню пінистих клітин, інгібуючи експресію НАДФН-оксидази‑1 і продукуючи хемотаксичний білок‑1 моноцитів у макрофагах [58].
Відомо, що ресвератрол існує у двох ізомерних формах – транс- і цис-ресвератрол. Ізомер транс- перетворюється на цис-форму під дією ультрафіолетового випромінювання. Транс-ресвератрол є основною біологічно активною формою [24, 33].
Не менш важливий вплив ресвератрол чинить на ліпідний профіль (рис.). Деякі доклінічні дослідження показали, що ресвератрол може зменшувати вміст тригліцеридів у плазмі крові та рівень ЛПНЩ, а також підвищувати значення ліпопротеїнів високої щільності (ЛПВЩ) [52]. Як повідомляють Cho та співавт., ресвератрол посилює гіпохолестерилемієнтну дію правастатину, знижуючи 3-гідрокси‑3-метил-глутарил-КоА-редуктазу (ГМГ-КоА-редуктазу) – фермент, який втручається в початкові ланки біосинтезу холестерину [53]. Крім того, ресвератрол може збільшити експресію рецепторів ЛПНЩ у гепатоцитах in vitro, тим самим сприяючи подальшому зниженню рівня холестерину ЛПНЩ у крові [54].
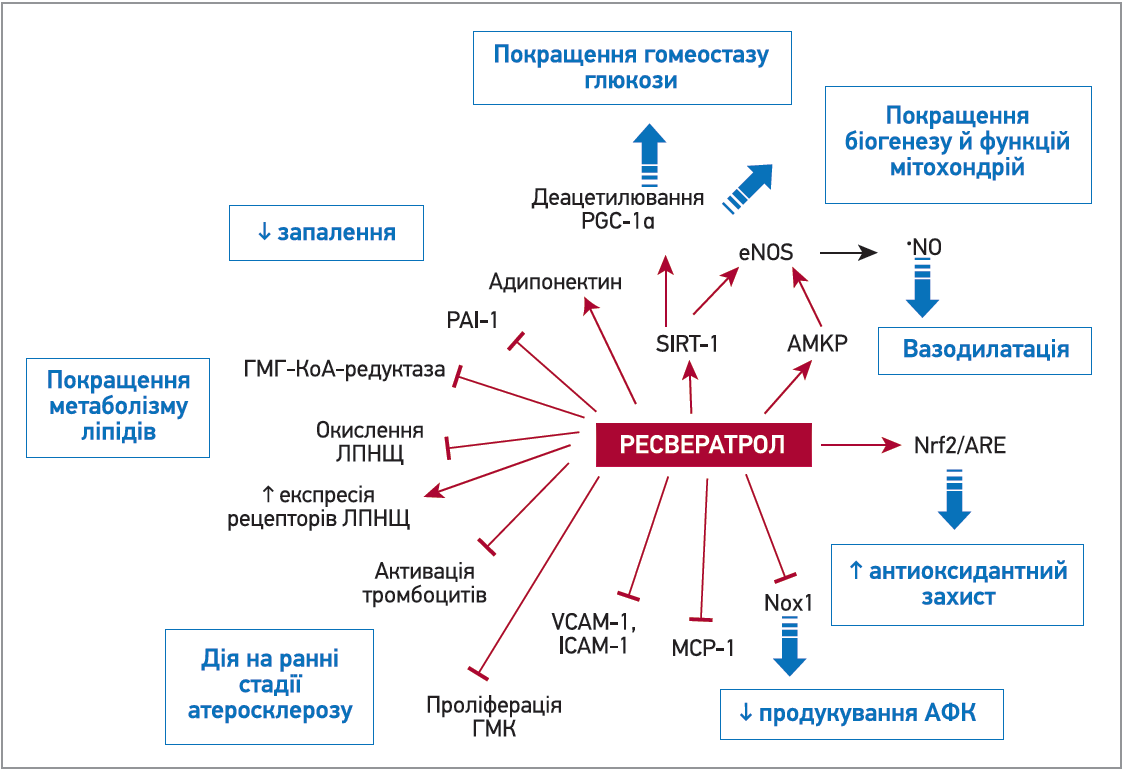
Усі ці властивості свідчать: ресвератрол діє на основні фактори, що беруть участь в атеросклеротичному процесі.
Що стосується клінічних досліджень, то було показано, що в пацієнтів із ЦД й ішемічною хворобою серця, гіперліпідемією й іншими кардіоваскулярними ризиками лікування ресвератролом (250 мг/добу протягом 3 міс) значно знижує рівні загального холестерину [82, 83], ЛПНЩ, загального й апо-ЛП ЛПНЩ [84]. Аналогічним чином під час прийому ресвератролу в дозі 20 мг/добу протягом 2 міс у пацієнтів зі стабільною стенокардією знижувався загальний рівень холестерину та тригліцеридів [79].
У рандомізованому подвійному сліпому плацебо-контрольованому перехресному дослідженні брали участь 52 особи з помірною гіперліпідемією. Пацієнти були розділені на дві групи й отримували або 200 мг/добу екстракту червоного винограду (RGSE), або плацебо протягом 8 тиж. Рівні ліпідного профілю досліджували в усіх хворих на початку та наприкінці дослідження. Споживання RGSE знизило рівні загального холестерину (10,68±26,76 мг/дл, р=0,015), ЛПНЩ (9,66±23,92 мг/дл, р=0,014) та окислених ЛПНЩ (5,47±12,12 мг/дл, р=0,008) [85].
Встановлено, що в пацієнтів із ЦД при тяжкій формі захворювання в стадії декомпенсації та за наявності кетоацидозу приєднується синдром гіперглікемії та гіперхолестеринемії. Позитивний гіпоглікемічний ефект ресвератролу у хворих на ЦД пояснюється впливом на внутрішньоклітинний транспорт глюкози. В експериментах на ізольованих клітинах ресвератрол стимулював поглинання глюкози в умовах відсутності інсуліну. У дослідженнях на тваринних моделях експресія інсулінозалежного транспортера глюкози збільшувалася після прийому ресвератролу. Ресвератрол також сприяв підвищенню експресії адипонектину та покращував чутливість до інсуліну в адипоцитах [81].
У рандомізоване несліпе плацебо-неконтрольоване дослідження з двома паралельними групами [82] було включено пацієнтів із ЦД 2 типу (n=62), які отримували протидіабетичні препарати та 250 мг/добу ресвератролу (n=28) або лише протидіабетичні препарати (контрольна група; n=29) протягом 3 міс. Оцінювали ефект ресвератролу на глікемічний профіль й асоційовані з ним ризик-маркери. За результатами прийому ресвератролу було відзначено зниження рівнів систолічного АТ на 8,4%, глікованого гемоглобіну (HbA1c) – на 5% і загального холестерину – на 8,5%.
Окрім того, було виявлено значні відмінності між групою ресвератролу та контрольною групою щодо рівнів глюкози в крові натще, HbA1c, систолічного та діастолічного АТ, загального холестерину, тригліцеридів, ЛПНЩ [86].
Що стосується впливу ресвератролу на зниження рівня глюкози натще в плазмі, це було продемонстровано за результатами клінічних досліджень порівняно з плацебо в пацієнтів із ЦД 2 типу. Значне зниження HOMA-IR у разі прийому ресвератролу було показано в дослідженнях за участю 153 пацієнтів [87].
Антиоксидантні властивості ресвератролу також відіграють певну роль у його захисному впливі на пошкодження міокарда. Дійсно, реперфузія після ішемії індукує велику продукцію АФК, відповідальних за пошкодження тканин, а ресвератрол здатний індукувати механізми антиоксидантного захисту й обмежувати ПОЛ за цих умов. Окрім того, в моделі свиней із хронічно ішемізованим міокардом ресвератрол сприяв збільшенню рівня пероксиредоксину‑2 – білка, котрий, як відомо, поглинає вільні радикали [74]. Тісно пов’язане з ОС запалення також є ключовим фактором при пошкодженні міокарда ішемією. Нещодавнє дослідження було проведено на щурах з ішемією міокарда зі введенням ресвератролу на початку реперфузії [75]. Результати дають змогу припустити, що під час процесу активувався домен Натча, при цьому секреція запальних цитокінів IL‑1β та IL‑18 опосередковувала каскадну запальну реакцію.
На моделях інфаркту, отриманих шляхом перев’язки лівої передньої низхідної коронарної артерії, ресвератрол стимулював зменшення розміру інфаркту та поліпшення серцевої діяльності [31, 68]. На моделі метаболічного синдрому та хронічної ішемії міокарда в свиней додавання ресвератролу забезпечувало значне покращення показників маси тіла, концентрації холестерину та СРБ у сироватці крові, толерантності до глюкози та метаболізму міокарда [69].
Ресвератрол може запобігати проявам серцево-судинних ускладнень, пов’язаних з ішемічною хворобою серця [71, 72]. Є низка клінічних досліджень, які довели кардіопротекторний вплив ресвератролу. Паралельне рандомізоване потрійне сліпе плацебо-контрольоване дослідження за участю пацієнтів зі стабільною стенокардією чи гострим коронарним синдромом показало, що прийом екстракту винограду чи ресвератролу сприяв збільшенню рівня адипонектину, зменшенню вмісту інгібітора активатора плазміногену‑1 і ліпідів у крові. Це було 3-місячне дослідження, що включало 40 пацієнтів після інфаркту міокарда (26 чоловіків і 14 жінок), які отримували лікування, або плацебо, або 10 мг ресвератролу на день зі стандартними препаратами. Автори дійшли висновку, що в поєднанні зі стандартною терапією лікування ресвератролом пацієнтів після інфаркту міокарда знизило рівень ЛПНЩ на 8%, значно покращило ендотеліальну функцію (приблизно від 2 до 4,5%), яка визначалася за допомогою потік-опосередкованої дилатації, та діастолічну функцію лівого шлуночка – на 2% порівняно з вихідними даними; та може бути перспективним способом зменшення ризику повторного епізоду [77-79].
Vaisman і співавт. вивчали ефект дієтичного споживання порошку шкірки червоного винограду (RGC) на рівень АТ у 50 пацієнтів із прегіпертензією та легкою гіпертензією. У цьому дослідженні 2015 р. пацієнти споживали 200, 400 мг RGC або плацебо щодня протягом 12 тиж. Порівняно з групою плацебо було описано суттєве зниження рівня діастолічного АТ (р=0,032) у групі пацієнтів, які приймали 200 мг RGC.
Зниження систолічного АТ на 3 мм рт. ст. та діастолічного АТ на 2 мм рт. ст. у 60 нелікованих пацієнтів із помірною гіпертонічною хворобою показано після споживання екстракту виноградного вина, що містить 800 мг поліфенолів. Показники добового моніторингу АТ також були нижчими при вживанні екстракту виноградного вина (135,9±1,3 мм рт. ст.) порівняно з плацебо (138,9±1,3 мм рт. ст.) [88].
Прийом ресвератролу в дозі 30, 90 або 120 мг сприяв значному збільшенню потікопосередкованої дилатації брахіальної артерії, яка є іншим важливим маркером ССЗ. Це було показано як для пацієнтів із надмірною вагою / ожирінням, так і в постменопаузальних групах із неконтрольованою пограничною АГ [89]. Також у разі прийому 10 мг ресвератролу щодня протягом 3 міс було отримано подібні результати в пацієнтів після інфаркту міокарда [90].
Щодо протизапальної дії ресвератролу, то вона проявляється активацією Nrf2 та пригніченням прозапальної продукції цитокінів у кардіоміоцитах, тим самим полегшуючи ендотоксин-індуковане пошкодження міокарда в мишей, що може бути потенційним способом запобігання індукованій сепсисом кардіоміопатії [60].
З’являється дедалі більше доказів того, що ресвератрол пригнічує агрегацію тромбоцитів у людини. Показано, що ресвератрол інгібує циклооксигеназу‑1 [61], що, ймовірно, пояснює його аспіриноподібні ефекти. Останні дослідження виявили, що ресвератрол ефективно пригнічує агрегацію тромбоцитів у пацієнтів із резистентністю до аспірину [24].
Виражений нейропротекторний ефект було продемонстровано в нещодавньому дослідженні на щурах [62]. Автори показали, що ресвератрол інгібує фосфодіестеразу та регулює шлях цAMФ/AMФK, що зменшує споживання енергії АТФ під час ішемії. Подібним чином ресвератрол зменшував розмір інфаркту на моделі фокальної церебральної ішемії в щурів [63]. Лікування ресвератролом дало змогу запобігти індукованому ЦД погіршенню eNOS-залежної вазорелаксації в церебральних артеріолах у щурів із ЦД [64], що може бути корисним для лікування цереброваскулярної дисфункції у хворих на ЦД.
У дослідженні 2014 р. Witte та співавт. продемонстровано підсилення мозкового кровообігу в дорослих у разі введення 250 або 500 мг ресвератролу на добу. На тлі прийому ресвератролу показано вплив на функцію мозку в здорових літніх осіб завдяки поліпшенню метаболізму глюкози та вазорелаксації шляхом стимуляції синтезу eNOS і NO [91].
В інших дослідженнях також було показано, що ресвератрол збільшує мозковий кровоток у здорових дорослих [65, 66], що може пояснювати потенційні сприятливі ефекти у хворих на інсульт. Подібним чином ресвератрол пропонується для посилення цереброваскулярної перфузії в жінок у постменопаузальному періоді [67].
Давно відомо про вплив антиоксидантів на збільшення тривалості життя, що має особливе значення при ЦД та ССЗ, які пов’язані з прискореним старінням. Серії досліджень доктора Д. Сінклера показали, що ресвератрол є активатором сиртуїнів – NAD+-залежних гістонових деацетилаз, які впливають на довжину теломерних ділянок хромосом. Ця властивість може пояснювати антивіковий ефект молекули. Є дані, що ресвератрол може інгібувати мітохондріальний дихальний ланцюг, який може впливати на співвідношення NAD+/NADH [24].
Позитивний вплив ресвератролу на зниження активності теломерази було продемонстровано на старих щурах, оброблених попередньо D-галактозою. На тлі використання D-галактози в тканинах мозку щурів спостерігалося зменшення активності теломерази, але при застосуванні ресвератролу простежувалося збільшення її активності [80].
Ресверазин® – натуральний фітокомплекс, до складу якого входять високоактивні природні антиоксиданти: ресвератрол 150 мг, екстракт червоного вина 100 мг та екстракт кісточок винограду 50 мг. Ресверазин® покращує обмін речовин при метаболічному синдромі, сприяє збільшенню чутливості клітин до інсуліну при ЦД 2 типу, виявляє дезінтоксикаційні властивості, зв’язує та нейтралізує вільні радикали при всіх станах, пов’язаних з ОС. Ресверазин® рекомендований за порушень серцево-судинної, нервової й ендокринної систем, офтальмологічної, гінекологічної й урологічної патологій, а також як допоміжний натуральний комплекс для зменшення токсичного впливу хіміотерапії в онкологічних пацієнтів. Ресверазин® доцільно вживати мешканцям регіонів з екологічно несприятливими умовами для усунення негативного впливу шкідливих факторів довкілля на організм, особам з ослабленим імунітетом, а також для підвищення життєвого тонусу та гальмування процесів фізіологічного старіння.
Висновки
-
Етіопатогенез ЦД та ССЗ тісно пов’язаний з ОС, у підвищенні якого задіяно множинні механізми. Атерогенез і дисфункція судинної стінки, що прогресує з віком, відіграють провідну роль у збільшенні захворюваності та ризику серцево-судинних подій, а їх прогресування залежить від цілої низки факторів: вивільнення запальних хемокінів і цитокінів, утворення АФК, посилення продукції факторів росту та проліферації непосмугованих міоцитів судин.
-
Одним із найвідоміших антиоксидантів рослинного походження є ресвератрол, для котрого в пацієнтів із гіперліпідемією й іншими кардіоваскулярними ризиками клінічно доведено вплив на ліпідний і глікемічний профілі, а саме зниження загального холестерину, тригліцеридів, ЛПНЩ, рівня глюкози натще в плазмі, а також систолічного та діастолічного АТ, що може позитивно впливати на запобігання розвитку ССЗ, у тому числі в пацієнтів високого ризику з ЦД.
-
Ресверазин® є сучасним фітофармацевтичним комплексом, який містить ресвератрол, екстракт червоного вина й екстракт кісточок винограду. Для цих діючих компонентів показано позитивний вплив на функцію ендотелію завдяки зменшенню запалення судинної стінки, агрегації тромбоцитів і проліферації гладком’язових клітин, а також властивість протидіяти утворенню пінистих клітин, що пригнічує атерогенез. У декількох клінічних дослідженнях доведено кардіопротекторний вплив ресвератролу, зокрема в пацієнтів зі стабільною стенокардією чи гострим коронарним синдромом показано збільшення рівня адипонектину, зменшення вмісту інгібітора активатора плазміногену‑1 і ліпідів у крові. У пацієнтів після інфаркту міокарда лікування ресвератролом у поєднанні зі стандартною терапією знизило рівень ЛПНЩ на 8%, значно покращило ендотеліальну функцію (приблизно від 2 до 4,5%) та діастолічну функцію лівого шлуночка – на 2% порівняно з вихідними даними; та може бути перспективним способом зменшення ризику повторного епізоду. Отже, ресвератрол може запобігати проявам серцево-судинних ускладнень, пов’язаних з ішемічною хворобою серця.