Ассоциация укорочения длины теломер с состоянием вегетативной нервной и антиоксидантной систем у пациентов пожилого возраста с церебральным атеросклерозом и сахарным диабетом 2-го типа
Публикация обновлена: Июль 19
Хроническая ишемия мозга (ХИМ) — медленно прогрессирующая недостаточность кровоснабжения мозга, приводящая к постепенному нарушению его функционирования с развитием многоочагового или диффузного ишемического поражения вследствие хрони- ческой гипоперфузии церебральных структур и проявляющаяся комплексом неврологичес- ких и нейропсихологических нарушений. Термин «ХИМ» введен в Международную классификацию болезней десятого пересмо- тра (МКБ-10): Рубрика 167.8 — ишемия мозга хроническая (Other specified cerebrovascular diseases: Cerebral ischaemia (chronic). В нашей стране этот термин используется вместо более широкого определения, включающего в том числе последствия острых сосудистых мозговых нарушений — «дисциркуляторная энцефалопатия». Развитие современных методов нейровизуализации показало, что существует возможность оценки снижения мозгового кровотока и метаболизма и подтвердило правомерность выделения ХИМ.
Механизмы, по которым формируется хроническое ишемическое поражение головного мозга, включают элементы нейродегенерации и воспаления преимущественно в белом веществе. Гипоперфузия сопровождается вовлечением в патологический процесс коры больших полушарий в относительно меньшей степени. Таким образом, ключевая роль в ряде изменений вследствие ХИМ у подавляющего большинства больных принадлежит не первичному поражению тех или иных корковых зон или систем, а нарушению связей между различными корковыми отделами и корковыми образованиями и субкортикальными структурами, приводящему к их разобщению. Выяснение механизмов биохимических изменений при развитии цереброваскулярных заболеваний является одной из главных проблем современной медицины.
Изменение функции и структуры сердечной мышцы в ответ на острую и хроническую ишемию головного мозга уже много лет рассматривают в рамках церебро-кардиального синдрома — сложного комплекса метаболических, структурных и электрофизиологических сдвигов, возникающих в миокарде в ответ на острую или хроническую ишемию головного мозга [3]. Доказано, что ишемическое повреждение мозга играет важную роль в развитии электрической нестабильности миокарда, одним из проявлений которой является снижение вариабельности ритма сердца (ВРС), используемое для прогнозирования тяжести и исхода заболевания [1, 9, 11]. Острое и/ или хроническое нарушение мозгового кровообращения приводит к изменению автономной регуляции сердечно-сосудистой системы, нарушению ВРС, повышению уровня катехоламинов в плазме и увеличению случаев кардиальных аритмий, что в свою очередь может обусловить увеличение вероятности внезапной смерти [1, 2, 5, 7, 12].
Известно, что в последние годы среди сосудистых болезней мозга увеличивается доля ишемических форм. С учетом прогрессирующего старения населения планеты проблема цереброваскулярных заболеваний обещает оставаться актуальной и в будущем. В условиях хронической церебральной ишемии запускается каскад биохимических реакций в ткани головного мозга, приводящий к внутриклеточному накоплению свободных радикалов, активации процессов перекисного окисления липидов, избыточной генерации активных форм кислорода и, как следствие, гибели нейронов. Как и в других тканях, в мозге есть антиоксидантная система (супероксиддисмутаза — СОД, каталаза, глутатионпероксидаза, глутатион — GSH), которая защищает его от свободных радикалов. Церебральная ткань восприимчива к окислительному стрессу из-за ее высокой потребности в кислороде. Система GSH необходима для защиты нейронов в условиях окислительного стресса [15, 17]. У пациентов старшей возрастной группы хроническая ишемия мозга часто развивается на фоне сахарного диабета (СД) 2-го типа, который является одним из наиболее распространенных заболеваний во всем мире. Число больных СД стремительно растет. По прогнозам экспертов ВОЗ, к 2025 году общее число больных может достичь 380 миллионов. При сочетании ХИМ и СД нарушается баланс в системе оксиданты/антиоксиданты. Установлено, что механизмы антиоксидантной защиты универсальны для всех живых [14]. По мере развития современных представлений становится все более понятной роль оксидативного стресса, представляющего собой дисбаланс между прооксидантами и антиоксидантными защитными механизмами организма как центрального звена патогенеза ряда острых и хронических состояний и заболеваний, таких как атеросклероз, СД, ишемия и др. [14]. В конечном итоге все эти воздействия могут приводить к напряжению и последующей декомпенсации механизмов антиоксидантной защиты организма и развитию оксидативного стресса, проявляющегося на клеточном, тканевом и органном уровнях.
Количество теломер, потерянных во время каждого деления клеток, варьируется у разных людей. Предыдущие исследования показали, что увеличение окислительного стресса и хронического воспаления связаны с более высокой потерей теломер и ускоренным их укорочением [10, 12]. Несколько общих факторов риска для сердечно-сосудистых заболеваний, таких как курение, сахарный диабет, гиперхолестеринемия, гипертензия, ожирение, низкая физическая активность, потребление алкоголя и психосоциальные проблемы, были связаны с короткой длиной теломер. Однако механизм, лежащий в основе объединения укорочения длины теломер с этими факторами риска, остается гипотетическим.
Целью данного исследования было определение взаимосвязи длины теломер с показателями оксидативного стресса и вариабельности ритма сердца у пациентов с церебральным атеросклерозом на разных стадиях, в том числе перенесших ишемический атеротромботический инсульт, а также выявление влияния вышеуказанных факторов на прогноз укорочения длины теломер у данной категории пациентов.
Материал и методы
В комплексном клинико-инструментальном исследовании приняли участие 84 пациента с церебральным атеросклерозом (ЦА) 1-3-й степени и СД. Диагноз «Церебральный атеросклероз» формулировался в соответствии с классификацией атеросклероза ВОЗ 2015 года и подтверждался данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга).
Дизайн исследования: простое, проспекивное, нерандомизированное, с последовательным включением пациентов.
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с некорригируемым артериальным давлением (АД) >160/90 мм рт. ст., другими нарушениями ритма, требующими проведения антиаритмической терапии, снижением фракции выброса (ФВ) <40% по данным двухмерной эхокардиографии (ЭхоКГ), клинически выраженной сердечной недостаточностью, значительно выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. Также в исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца. Все проходили общепринятое клиническое, лабораторное (общий анализ крови и мочи, определение липидного профиля, уровня креатинина, мочевины, глюкозы, аспартатаминотрансферазы, аланинаминотрансферазы, билирубина) и инструментальное обследование (трансторакальная ЭхоКГ, электрокардиография (ЭКГ), ультразвуковая допплерография сосудов головы и шеи, МРТ головного мозга).
Протокол исследования одобрен комитетами по этике ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины» и ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины». Все участники дали письменное информированное согласие. Хельсинкская декларация (2000 г.) и применимые национальные стандарты, касающиеся их участия в исследованиях, были учтены.
Образцы крови отбирали в вакутайнеры, содержащие ЭДТА. На протяжении 30 минут после забора крови производили выделение мононуклеарных клеток периферической крови на градиенте (1,077 г/см3). После выделения клетки замораживали и хранили в жидком азоте при –196 °C. Выделение ДНК производили из размороженных клеток, используя метод фенол-хлороформной очистки [14]. Контроль чистоты, концентрации и целостности ДНК проводили с помощью спектрофотометрии и агарозного гель-электрофореза.
Относительные длины теломер (ОДТ) измеряли с помощью мультиплексной количественной полимеразной цепной реакции в реальном времени (RT-qPCR — кПЦР-РВ) [4]. Реакционная смесь для ПЦР была приготов- лена с использованием коммерческого набора реагентов Luna® Universal qPCR и RT-qPCR (New England Biolabs) с добавлением бетаи- на (Sigma-Aldrich) до конечной концентрации
1 М. Для мультиплексной кПЦР пара теломерных праймеров telg и telc (конечные концентрации каждого — 450 нмоль) была объединена с парой праймеров альбумина albu и albd (конечные концентрации каждого — 250 нмоль) в мастер-микс. Список праймеров, используемых для анализа кПЦР-РВ, приводится ниже в таблице 1.
Таблица 1. Список праймеров, использованных для количественной полимеразной цепной реакции в реальном времени (кПЦР-РВ)

Профиль термоциклирования был следующим: 95 °C — 15 мин.; 2 цикла: 94 °C — 15 с и 49 °C — 15 с; 32 цикла: 94 °C — 15 с, 62 °C — 10 с, 74 °C — 15 с и с получением сигнала, 84 °C — 10 с, 88 °C — 15 с и с получением сигнала. Для формирования калибровочной кривой ПЦР проводили для четырех концен- траций эталонной ДНК (в двух экземплярах), которые охватывают диапазон 27-кратных серийных разведений.
Все образцы ДНК были проанализированы в триплетах. Кривые амплификации были сгенерированы программным обеспечением Opticon Monitor 3. Для этого после термоциклирования и сбора исходных данных с помощью программного обеспечения Opticon Monitor 3 для каждой постановки были построены две стандартные кривые: для теломерного сигнала и для гена сигнала однокопийного гена альбумина. ОДТ были выражены в виде отношения T/S, где Т — число теломерных повторов, а S — число повторов гена альбумина.
Теломеразную активность определяли с помощью протокола амплификации тандемных повторов с детекцией в реальном времени (ПАТП-РВ) [2]. Мононуклеарные клетки периферической крови и клетки HEK293 (положительный контроль) обрабатывали буфером для лизиса NP-40 от Invitrogen (50 ммоль Трис, рН 7,4, 250 ммоль NaCl, 5 ммоль ЭДТА, 50 ммоль NaF, 1 ммоль Na3VО4, 1% Nonidet™ P40 (NP40) 0,02% NaN3) с 1 ммоль PMSF (Sigma-Aldrich) и 10 мкл/мл (об./об.) раствора с ингибитором протеаз (Sigma-Aldrich) на льду в течение 30 минут. Последующее центрифугирование проводили при 16 400 g в течение 20 мин. при +4 °C. 180 мкл супернатанта переносили в свежую пробирку. Измерение концентрации белка проводили с помощью набора для анализа белка Pierce™ BCA (Thermo Scientific) согласно протоколам производителя.
Реакционную смесь для кПЦР-РВ готовили на основе Luna Universal qPCR и RT-qPCR (New England Biolabs) с добавлением EGTA до конечной концентрации 5 мМ, конечная концентрация праймеров была 400 нМ для ACX и 400 нМ для TS. 2 мкл лизата добавляли к 23 мкл смеси ПАТП-РВ и инкубировали в течение 30 мин. при 30 °C. Затем проводили ПЦР при следующих условиях: 95 °C — 1 мин.; 40 циклов: из 95 °C — 15 с, 60 °C — 1 мин. и с по- лучением сигнала. ПЦР-продукты были количественно определены с помощью Chromo4 (Bio-Rad) и проанализированы в программном обеспечении Opticon Monitor v3.1. Клетки НЕК293 использовали для генерации стандартной кривой, построенной на точках пяти вариантов разведений.
Для определения активности каталазы использовали гемолизат крови, который получали путем осмотического гемолиза цельной крови с дистиллированной водой и одного цикла замораживания с последующим центрифугированием. Разведенный гемолизат крови инкубировали с раствором гидрогена пероксида и спектрофотометрически определяли активность каталазы по количеству продукта реакции остаточного гидрогена пероксида с молибдатом аммония [13]. Для создания калибровочного графика использовали раствор коммерчески доступной каталазы (Sigma, С9322). Результаты выражали в единицах активности фермента на 1 мл крови.
Активность СОД (КФ 1.1.15.1.) в плазме крови определяли непрямым спектрофото-метрическим методом на основе реакции супероксидзависимого окисления кверцетина, в щелочной среде, в присутствии тетраметилетилендиамина [17]. Реакция сопровождается обесцвечением рабочего раствора в обла- сти пропускания с максимумом при 406 нм. Фермент СОД перехватывает супероксидрадикалы и подавляет окисление кверцетина. При времени инкубации 20 мин. степень ингибиции строго количественно зависит от концентрации СОД. Содержание фермента в биологическом материале рассчитывается с помощью калибровочного графика, полученного на основании измерения активности коммерчески доступной СОД (Sigma, S9697). Активность СОД выражали в единицах активности на 1 мл плазмы.
Концентрацию ТБК-активных продуктов (МДА) определяли, используя реакцию на- гревания малонового диальдегида с 2-тиобар- битуровой кислотой (ТБК) в кислой среде с образованием окрашенного триметинового комплекса с максимумом флуоресцентного из- лучения при µ=530 нм при условиях возбужде- ния светом из µ=484 нм [25, 26]. Плазму крови инкубировали с ТБК в присутствии трихлоруксусной кислоты при нагревании. После охлаждения образцов проводили экстракцию ТБК-активных продуктов н-бутанолом. Интенсивность флуоресценции измеряли на спектрофлуориметре. Концентрацию ТБК-активных продуктов (МДА) рассчитывали по калибровочной кривой, созданной с использованием коммерческого МДА (Sigma, 63287), и выражали в мкМ/л.
Содержание GSH в плазме крови определяли спектрофлуориметрическим методом с использованием ортофталевого альдегида, в результате реакции которого с GSH образуются высокофлуоресцентные продукты, которые возбуждаются излучением при 350 нм и имеют четко выраженный пик флуоресценции при 420 нм [18]. Концентрацию GSH рассчитывали по калибровочной кривой, созданной с использованием коммерческого GSH (Синбиас, Украина) и выражали в мкМ/л. Интенсивность флюоресценции гликированных протеинов в плазме крови измеряли при возбуждении 370 нм и эмиссии 440 нм с помощью спектрофлуорометра Varioscan и выражали в мкМ/л [7]. Для создания калибровочной кривой был приготовлен условный гликированный белок — bsa-глюкоза. Смесь BSA и d-глюкозы в фосфатном буфере инкубировали при 37 °C в течение 6 недель.
Исследование ВРС проводили на аппарате Schiller AT-10 plus (Швейцария) с использованием статистического анализа временной области и спектрального анализа короткой (пятиминутной) последовательности электрокардиографических интервалов R–R в состоянии покоя. Определяли следующие показатели временного анализа: стандартное отклонение (SDNN, мс), стандартное отклонение разностей продолжительности соседних интервалов R–R (RMSSD, мс). При выполнении спектрального анализа определяли: общую мощность спектра ритма сердца (tP, мс2), мощности в диапазоне 0,00-0,04 Гц (Vlf, мс2), 0,04-0,15 Гц (lf, мс2), 0,15-0,4 Гц (hf, мс2) и со- отношение lf/hf. Спектральные составляющие lf и hf анализировали как в абсолютных значениях, так и в производных от них нормализованных единицах (н.е.), которые автоматически рассчитывались по формулам: lfnorm = lf / (tP – Vlf) × 100% и hfnorm = hf / (tP – Vlf) × 100%. Определяли также структуру спектра в процентном соотношении составляющих:%Vlf, %lf, %hf.
Систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) (мм рт. ст.) измеряли дважды с помощью стандартного сфигмоманометра в положении пациента сидя после не менее 10 мин. отдыха. Уровни глюкозы в плазме определяли стандартным глюкозооксидазным методом.
Для представления результатов в случае количественных переменных рассчитывали среднее значение показателя и его средне-квадратическое отклонение (±SD) в случае нормального закона распределения либо медианное значение показателя (Me) и значения первого (QI) и третьего (QIII) квартилей в случае закона распределения, отличного от нормального. Проверку распределения на нормальность проводили с использованием критерия Шапиро-Уилка. Для представления качественных признаков рассчитывали их частоту (%). При проведении сравнения количественных показателей в двух группах использовали t-критерий (в случае нормального закона распределения), критерий Ман-на-Уитни (в случае закона распределения, отличного от нормального). При проведении сравнения качественных показателей использован точный критерий Фишера. Критический уровень значимости во всех случаях — 0,05.
При проведении анализа связи факторных признаков с риском укорочения длины теломер использован метод построения и анализа моделей логистической регрессии [10]. Для оценки адекватности моделей использован метод анализа кривых операционных характеристик (ROC-кривые), рассчитывали площадь под кривой (AUC) и ее 95% доверительный интервал (95% ДИ). Для оценки направления и силы связи факторных признаков с риском укорочения длины теломер рассчитывали показатель отношения шансов (OR) и соответствующий 95% ДИ. Статистический анализ выполнен в программе MedCalc v. 19.1.3 (MedCalcSoftwareInc., Broekstraat, Бельгия, 1993-2019) [10].
Результаты и обсуждение
Пациенты были разделены на 2 группы в зависимости от относительной длины теломер (табл. 2). Медиана относительной длины теломер составила 2,848. Все пациенты со значением длины теломер ниже этого показателя были отнесены к группе коротких теломер (I), а те, у которых этот показатель превышал данное значение — к группе длинных теломер (II). Доля мужчин составила 21,2% в 1-й и 52,0% во 2-й группах.
Для выявления связи показателей, представленных в таблице 2, с укорочением длины теломер использовали метод построения логистических моделей регрессии. Важно учитывать и тот факт, что именно комбинация факторов риска, а не каждый фактор риска по отдельности, может приводить к укорочению теломер [16]. Для отбора совокупности значимых факторов риска использовали метод пошагового включения/исключения признаков (Stepwise при пороге исключения p>0,2 и по- роге включения p<0,1). На выделенных значимых факторах риска была построена многофакторная модель логистической регрессии, в которую вошли показатели, представленные в таблице 3. Факторы, которые не представлены в таблице, в данную модель не вошли. Была установлена статистически значимая положительная связь риска укорочения теломер с индексом вегетативной регуляции ритма сердца (НЧ/ВЧ) и концентрацией TBARs.
Выявлена хорошая согласованность выделенных факторных признаков с риском укорочения теломер — AUC=0,65 (95% ДИ 0,69- 0,96) (рис.), что может указывать на полноту модели и предикторов укорочения длины теломер, рассмотренных в данном исследовании. Все представленные в таблице 3 показатели являются весомыми в общей многофакторной модели.
Таблица 2. Основные клинические характеристики и маркеры оксидативного стресса в зависимости от относительной длины теломер
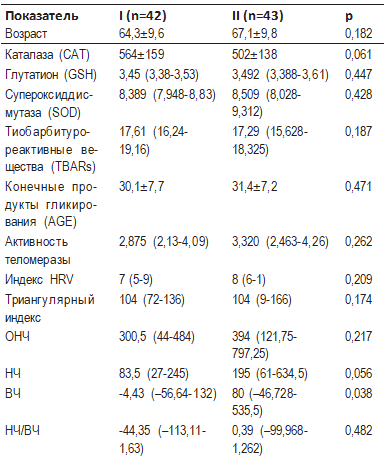
Примечание: приведено среднее значение ±SD в случае нормального закона распределения, Me (QI; QIII) в случае закона распределения, отличного от нормального.
Таблица 3. Многофакторный анализ прогнозирования укорочения длины теломер с показателями оксидативного стресса, ВРС, длины теломер и активности теломеразы (модель логистической регрессии)

Примечание: p0,05 — отличие коэффициента модели от 0 статистически значимо.
Многочисленные исследования подтвердили высокую прогностическую значимость определения спектральных показателей ВРС: НЧ/ВЧ отражает общую мощность спектра воздействия обоих отделов вегетативной нервной системы, ВЧ — изменения тонуса парасимпатической нервной системы, НЧ — симпато-парасимпатическое влияние, ОНЧ — гуморальную регуляцию. Достоверно более низкие значения ВЧ в группе пациентов с более короткой длиной теломер свидетельствует о преобладании симпатического тонуса у данной категории пациентов, что характерно для состояния стресса и неблагоприятно сказывается на деятельности сердечно-сосудистой системы [2, 3]. В поисках причин связи ВРС с относительной длиной теломер мы рассмотрели клеточное старение. В 1961 г. Hayflick L. экспериментально установил, что способность соматических клеток человека к пролиферации ограничена. После прекращения деления в клетках происходят необратимые изменения, ведущие к ее гибели. Старение клетки, основанное на лимите Hayflick L., получило название репликативного. Укорочение теломер стало одной из теорий, объясняющих процесс репликативного старения. Когда длина теломер достигает критического размера, клетка переходит в терминальное не делящееся состояние — клеточное старение [9].
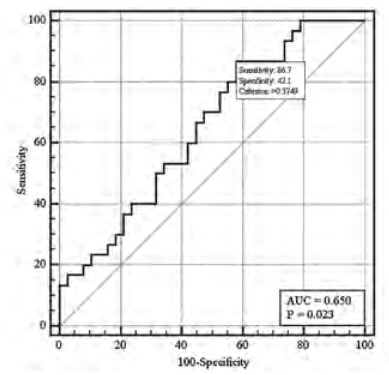
Рис. ROC-кривая 2-факторной модели прогнозирования риска укорочения теломер, AUC=0,65 (95% ДИ 0,69-0,96)
Существует предположение, что длина теломер как маркер биологического возраста связана с возрастными изменениями вегетативной регуляции ритма сердца. По результатам настоящего исследования прогноз укорочения длины теломер ассоциирован с общей мощностью спектра воздействия обоих отделов вегетативной нервной системы. Механизмом связи длины теломер с НЧ/ВЧ может быть репликативное старение нейронов ВНС и кардиомиоцитов.
Клинические работы по изучению взаимосвязи длины теломер с показателями ВРС немногочисленны. Было обнаружено, что у мужчин с меньшей длиной теломер отмечается замедленное восстановление временных параметров ВРС и САД в ответ на стресс по сравнению с группой мужчин с более длинными теломерами [14].
Ученые выявили, что у детей 5-6 лет с короткими теломерами в ответ на задания (стресс) отмечалась более высокая симпатическая и низкая парасимпатическая активность. Эти данные дают основания предполагать, что реакция ВНС в ответ на стресс генетически предопределена и связана с длиной теломер [15].
Выводы
1. ВРС и TBARs у пациентов с церебральным атеросклерозом и сахарным диабетом связаны с длиной теломер — маркером клеточного старения.
2. Длина теломер может стать ранним маркером ослабления автономной регуляции сердечной деятельности и отражать истинный биологический возраст ВНС.




