Атеросклероз и структурно-функциональное состояние сосудов каротидного и вертебро-базиллярного бассейнов
Публикация обновлена: Июль 19
С каждым годом статистика констатирует рост показателей заболеваемости и смертности от сердечнососудистых заболеваний и в первую очередь таких, как ишемический инсульт и инфаркт миокарда.
Следует отметить, что заболеваемость и смертность от инсульта в Украине значительно выше, чем в странах Европы и США. Среди всех нарушений мозгового кровообращения (НМК) ишемические инсульты диагностируют в 75–80% случаев [1, 2, 19]. Наиболее частой причиной тромбоокклюзирующего поражения сосудистой системы мозга является атеротромбоз – генерализованный и прогрессирующий процесс, зависящий от эволюции атеросклеротических изменений в сосудах.
Согласно современной концепции атеросклероза и атеротромбоза, клиническая манифестация большинства сердечнососудистых катастроф непосредственно связана с моментом нарушения целостности атеросклеротической бляшки [3, 4]. Принципиально важным звеном патогенеза атеросклероза и его осложнений (атеростеноз, атеротромбоз, атероэмболия, атероокклюзия, кровоизлияния в бляшку с последующей тромбоэмболией) является эндотелиальная дисфункция. Эндотелий (внутренняя выстилка сосудов) состоит приблизительно из 1,6×1013 клеток, общим весом около 1 кг и общей площадью ≈ 900 м2 . Эндотелиоциты имеют выраженную метаболическую активность и выполняют различные функции. Именно поэтому эндотелий, по сути, может рассматриваться как самая большая эндокринная железа.
Эндотелий является не только органом-мишенью, но и эффектором при различной сердечно-сосудистой патологии:
– вырабатывает различные биологически активные вещества,
– принимает самое активное участие в поддержании сосудистого тонуса, атеромбогенности сосудистой стенки, регуляции адгезии и агрегации тромбоцитов,
– проявляет про- и антикоагулянтную, фибринолитическую активность,
– участвует в процессах воспаления [5–7, 18].
Этапы эволюции атеросклеротической бляшки ассоциированы с эндотелиальной дисфункцией. Дисфункция эндотелия, согласно наиболее современной гипотезе, развивается вследствие хронического его повреждения, что приводит к адгезии тромбоцитов к субэндотелиальному слою и их агрегации, высвобождению факторов роста, способствующих миграции гладкомышечных клеток из медиа в интиму с образованием фиброзных бляшек. Важную роль в механизмах атерогенеза играет также гемодинамический фактор, проявляющийся повреждающим локальным воздействием потока крови на стенку сосуда, на его эндотелий в местах физиологических изгибов и бифуркаций.
Процесс формирования атеротромботического поражения сосуда сложен, многокомпонентен и зачастую очень длителен. Атеротромбоз артерий головы, также как и атеротромбоз в других сосудистых бассейнах, начинается с дестабилизации атеросклеротической бляшки, которая за счет пристеночного тромбообразования может увеличиваться в объеме, приводя к полной закупорке просвета артерии. Таким образом, исходом атеросклеротического поражения сосудистой системы мозга может быть развитие ишемических НМК. Вместе с тем достаточно долго – годы, а порой и десятилетия – процесс может быть клинически асимптомным. При каких обстоятельствах и что может послужить причиной клинической манифестации асимптомного поражения внутренней сонной артерии (ВСА), иначе говоря, чем и когда инициируется атеросклеротическая бляшка, превращаясь в агрессивную и потенциально опасную в плане возникновения НМК, является предметом активной дискуссии.
Имеются противоречивые сообщения о значении степени стеноза ВСА как фактора риска развития ишемического инсульта. Некоторые авторы придерживаются мнения, что угроза развития ишемических НМК в значительной степени зависит не только от степени стеноза ВСА, но и от строения атеросклеротической бляшки. Исследование связи между степенью стеноза и частотой развития инсульта показало их прямую зависимость – так, при стенозах гомолатеральной ВСА выраженностью более 90% частота развития инсульта достигает 32–35% [8, 9]. По данным других авторов, 37% инсультов сочетались с эхонегативными (гипоэхогенными по данным ультразвуковой диагностики) атеросклеротическими бляшками ВСА, тогда как наличие гетерогенных атеросклеротических бляшек определялось лишь у 18% больных с инсультом [10].
Выделены морфологические особенности бляшки, которые могут влиять на повышении риска развития инсульта:
– величина бляшки (степень стеноза),
– состояние поверхности (гладкая или с изъязвлениями),
– гистологическая структура (отложения липидов и атероматозных масс, фиброз, обызвествления, геморрагии) [11, 12].
Широкое внедрение новейших методов нейровизуализации, в том числе ультразвуковых исследований, позволило увеличить степень выявляемости атеросклеротического процесса в сосудах мозга, а также процент их асимптомного поражения.
В связи с современными патогенетическими представлениями о механизмах развития ишемического инсульта ранняя диагностика этого заболевания приобретает еще большую значимость. Актуальным на современном этапе становится вопрос об информативности неинвазивных ультразвуковых методов исследования, используемых для изучения состояния мозговых артерий, которые участвуют в кровоснабжении головного мозга [13, 17].
Цель исследования: изучение структурно-функционального состояния сосудов каротидного и вертебро-базиллярного бассейнов у пациентов пожилого возраста с церебральным атеросклерозом (ЦА) 1–3 стадии, в том числе в зависимости от полушарной локализации ишемического очага.
МАТЕРИАЛЫ И МЕТОДЫ
В комплексном клинико-инструментальном исследовании приняли участие 229 пациентов с ЦА 2–3-й степени. Диагноз «Церебральный атеросклероз» устанавливался в соответствии с классификацией атеросклероза Всемирной организации здравоохранения от 2015 года и подтверждался данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга).
Пациенты были разделены на 4 группы:
І – общая группа пациентов, перенесших ишемический атеротромботический инсульт в бассейне средней мозговой артерии (ИИ);
ІІ группа – в правом полушарии (ПП);
ІІІ группа – перенесшие ИИ в левом полушарии (ЛП);
ІV группа – с ЦА 1–2-й степени (без ИИ – группа сравнения).
В дальнейшем в сравнении групп участвовали пациенты пожилого возраста – от 55 до 75 лет (табл. 1).
Дизайн исследования: простое проспективное нерандомизированное, с последовательным включением пациентов.
Проводилось на базе отдела сосудистой патологии головного мозга ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины», г. Киев.
Критерии исключения из исследования:
– пациенты со всеми формами фибрилляции предсердий,
– некорригируемое артериальное давление (АД) > 160/90 мм рт.ст. и другие нарушения ритма, требующие проведения антиаритмической терапии,
– снижение ФВ < 40% по данным двухмерной эхокардиографии (ЭхоКГ),
– клинически выраженная сердечная недостаточность,
– значительно выраженные нарушения функции почек и печени,
– наркотическая или алкогольная зависимость,
– перенесенные острые воспалительные заболевания в течение предшествующего месяца.
Также в исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца.
Все пациенты проходили общепринятое клиническое, лабораторное и инструментальное исследование (ультразвуковая допплерография сосудов головы и шеи – исследование мозгового кровотока экстра- и интракраниальных отделов магистральных артерий головы и шеи на приборе Aplio XG (Toshiba), МРТ головного мозга). Все пациенты подписывали информированное согласие на участие в исследовании, которое было одобрено этическим комитетом ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» от 11 января 2016 года.
Больным проводилось комплексное исследование, включающее дуплексное сканирование магистральных артерий головы и шеи без предварительной подготовки в положении пациента лежа на спине и сидя на приборе Aplio XG (Toshiba) линейным датчиком, работающим в частотном диапазоне 7,0–10,0 МГц. Были изучены следующие гемодинамические параметры: линейная систолическая скорость кровотока (ЛССК), индекс пульсативности (PI), индекс периферического сопротивления (RI).
RI – индекс периферического сопротивления (индекс Пурсело) – косвенно характеризует состояние периферического сопротивления в исследуемом сосудистом бассейне. В артериях с низким периферическим сопротивлением он представляет собой отношение разности максимальной (пиковой) систолической и максимальной конечной диастолической скоростей к максимальной (пиковой) систолической скорости кровотока. Этот показатель отражает состояние сопротивления кровотоку дистальнее места измерения.
РI – индекс пульсативности (индекс Гослинга) – в артериях с низким периферическим сопротивлением представляет собой отношение разности максимальных систолической и диастолической скоростей кровотока к усредненной по времени максимальной скорости кровотока и отражает упругоэластические свойства артерий; с возрастом, как правило, имеет тенденцию к снижению [7, 8].
При оценке состояния кровообращения в артериях Виллизиева круга с помощью транскраниального дуплексного сканирования учитывались следующие параметры:
– варианты анатомического строения артерий,
– частота окклюзирующих поражений артерий,
– функциональное состояние артерий,
– степень перестройки гемодинамики в артериях Виллизиева круга на стороне инфаркта и противоположной стороне.
Статистический анализ проводили с помощью непараметрических методов (критерий Манна–Уитни). Результаты представлены в виде медианы и 25%, 75% квартилей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Анализируемые группы были сопоставимы по возрасту, полу и уровням систолического АД (САД), диастолического АД (ДАД), пульсового АД (ПАД) (см. табл. 1).
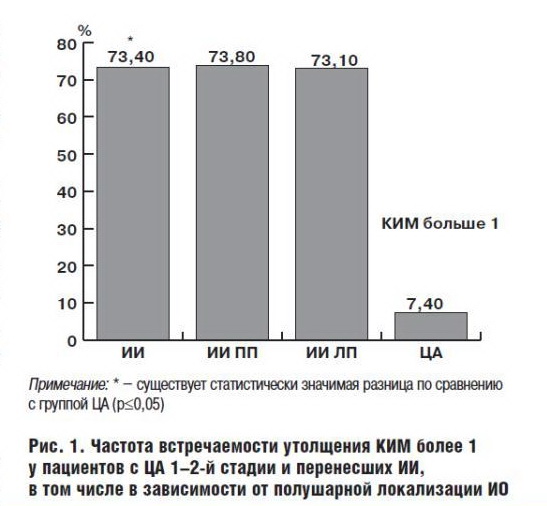
Основным ультразвуковым показателем, позволяющим косвенно оценить наличие структурной перестройки сосудистой стенки, является состояние комплекса интима-медиа (толщина, эхогенность, степень дифференцировки на слои). У 73,4% обследованных пациентов, перенесших ИИ, и у 7,4% пациентов с начальными проявлениями ЦА отмечается относительно равномерное повышение эхогенности и утолщение более 1,0 см КИМ ОСА с двух сторон с частичной утратой дифференцировки его на слои, причем статистически значимого отличия между группами пациентов с правополушарной и левополушарной локализацией ИО не наблюдалось (73,8% и 73,1% соответственно) (рис. 1).
Принимая во внимание значительную роль стенозирования в развитии ИИ и корреляцию степени стенозирования с риском развития ишемии мозга, была проанализирована частота клинически значимых (более 50%) и клинически незначимых (менее 50%) степеней стенозирования у пациентов с ЦА 1–2-й стадий и перенесших ИИ (рис. 2).
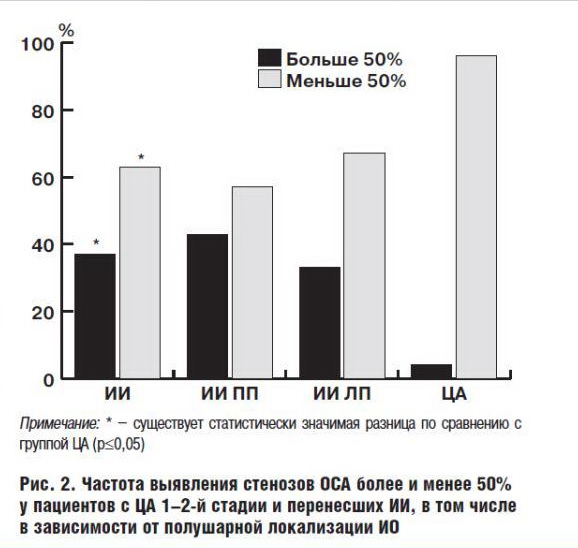
Данные рис. 2 свидетельствуют, что частота клинически значимых (более 50%) стенозов экстракраниальных сосудов каротидного бассейна у больных с ИИ была статистически значимо в 9 раз выше, чем у пациентов с ЦА 1–2-й стадии (37% и 4% соответственно), причем в группах пациентов с ИИ в зависимости от локализации ИО частота данных стенозов статистически значимо не различалась (43% и 33%), хотя в группе пациентов с ИО в ПП частота встречаемости стенозов более 50% на 10% была больше, чем в группе пациентов с локализацией ИО в ЛП.
Установив морфологические особенности церебральных сосудов у пациентов с ЦА 1–2-й стадии и перенесших ИИ, был проведен анализ изменений скоростных показателей (ЛССК), которые в значительной степени определяются функциональным состоянием сосудов. Сравнительная характеристика ЛССК, индекса периферического сопротивления (RI) и пульсаторного индекса (PI) представлены в табл. 2.
Согласно этим данным у пациентов с ЦА 1–2-й стадии отмечается статистически значимая разница ЛССК в некоторых сосудах каротидного и вертебро-базиллярного бассейнов: в правых и левых ОСА, СМА, ЗМА и в ОА. Так, у пациентов с ЦА 1–2-й стадий ЛССК в правой и левой ОСА и СМА в 1,2 раза выше, чем у пациентов с ИИ; в ОА ЛССК у пациентов с ЦА 1–2-й стадии в 1,4 раза выше, чем у пациентов с ИИ, а в правой и левой ЗМА ЛССК выше у пациентов с ЦА 1–2-й стадии в 1,3 раза по сравнению с группой постинсультных больных (см. табл. 2).
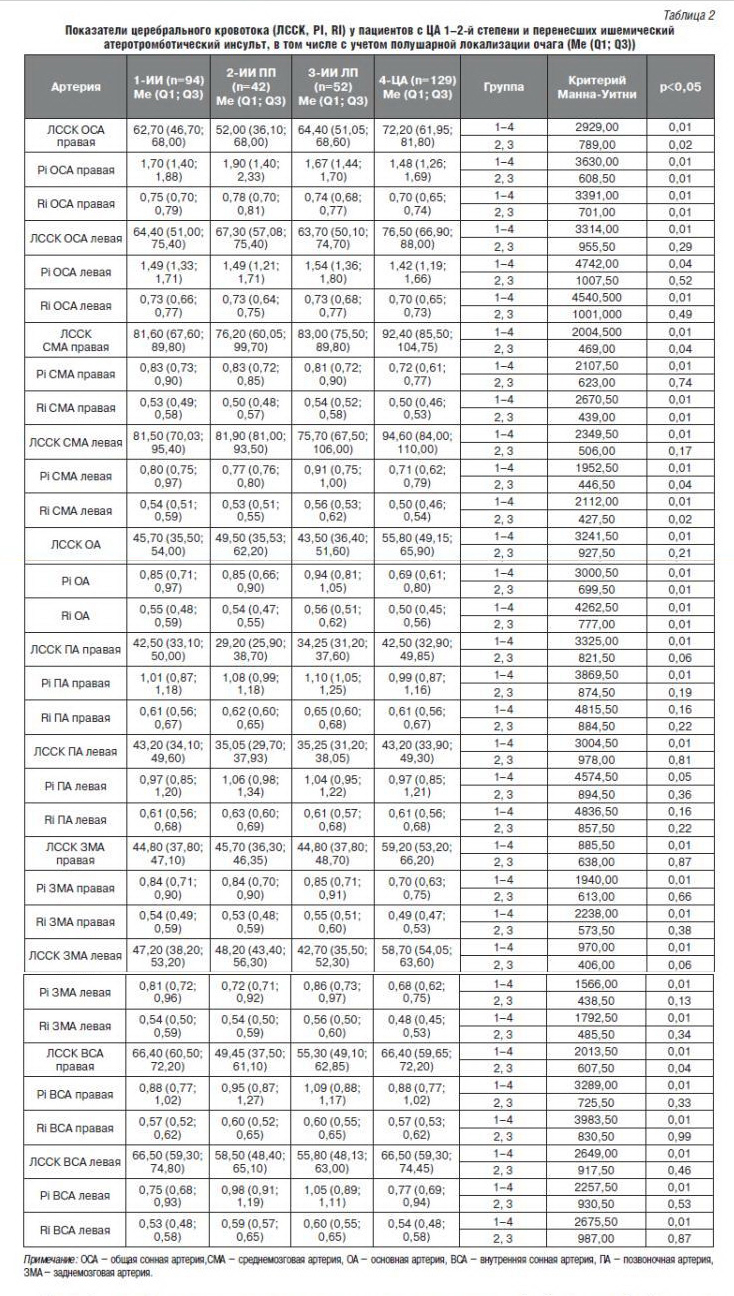
Как известно, структура изменения мозгового кровообращения у пациентов, перенесших ИИ, в восстановительный период имеет полушарные особенности. По данным С.М. Кузнецовой и соавторов, у пациентов с атеротромботическим ИИ более выражены изменения церебральной гемодинамики при локализации ИО в левом полушарии [20]. Учитывая эти данные, был также проведен анализ состояния мозгового кровообращения с учетом полушарной локализации ИО. Согласно данным табл. 2, полушарные отличия ЛССК наблюдались только в следующих сосудах каротидного бассейна справа: правые ОСА, СМА и ВСА. В правой ОСА в группе пациентов с ИО в ЛП ЛССК выше, чем у пациентов с ИО в ПП в 1,24 раза, в правых СМА и ВСА – в 1,1 раза.
Таким образом, необходимо подчеркнуть, что у пациентов с ЦА 1–2-й стадий по сравнению с пациентами, перенесшими ИИ, ЛССК статистически значимо выше в сосудах каротидного и вертебро-базиллярного бассейнов с обеих сторон, за исключением ПА и ВСА, тогда как полушарные отличия отмечаются только в интра- и экстракраниальных сосудах каротидного бассейна справа, причем у пациентов с локализацией ИО в ЛП ЛССК статистически значимо выше, чем у пациентов с ИО в ПП.
В некоторых исследованиях отмечено, что уменьшение скорости кровотока и, соответственно, уменьшение напряжения сдвига на определенном участке сосуда может являться причиной изменения его структуры, роста неоинтимы и уменьшения просвета. Ключевыми процессами морфологической перестройки сосудистой стенки, активирующимися при различных воздействиях, являются пролиферация, миграция клеток и изменение композитной структуры внеклеточного матрикса. Эти процессы управляются многочисленными факторами роста, рядом цитокинов, а также системами протеолитических ферментов, среди которых ведущую роль играют ферменты фибринолиза и матриксные металлопротеиназы [14–16].
В ходе многочисленных работ доказано, что при длительном повышении АД и/или ЦА адаптивные структурные изменения в стенке резистивных артерий способствуют повышению мозгового сосудистого сопротивления. При этом величина скорости мозгового кровотока обратно пропорциональна сопротивлению мозговых сосудов. Стандартными показателями, свидетельствующими о величине сосудистого сопротивления и определяющими уровень кровоснабжения мозга при допплерографии экстракраниальных сосудов, являются индекс резистентности и пульсационный индекс. Повышение указанных показателей наблюдается при вазоспастических реакциях у пациентов с АГ и/ или ЦА (см. табл. 2). Согласно этим данным у пациентов, перенесших ИИ, по сравнению с пациентами с ЦА 1–2-й стадий показатель эластичности статистически значимо выше в правых и левых СМА, ЗМА, правых ОСА и ПА, а также в ОА. Полушарные отличия наблюдались только в правой ОСА, левой СМА и в ОА, причем PI в правой ОСА статистически значимо в 1,14 раза выше у пациентов с ИО в ПП, а в левой СМА и в ОА – в 1,18 и в 1,1 раза соответственно у пациентов с ИО в ЛП.
Показатель периферического сопротивления сосудов у пациентов с ЦА 1–2-й стадий был статистически значимо ниже в правых и левых ОСА, СМА, ЗМА и ОА. В других сосудах каротидного и вертебро-базиллярного бассейнов статистически значимых различий не наблюдалось. Полушарные различия были определены только в правой ОСА (у пациентов с ИО в ПП статистически значимо выше, чем в ЛП), в правых СМА и ЗМА, левой СМА и ОА (у пациентов с ИО в ЛП статистически значимо выше, чем в ПП).
Таким образом, проведенное нами исследование выявило статистически значимое увеличение индекса сосудистого периферического сопротивления и пульсаторного индекса у пациентов, перенесших ИИ, что свидетельствует о напряженности механизмов ауторегуляции мозгового кровотока у данной категории больных в отдельных сосудах каротидного и вертебро-базиллярного бассейнов.
ВЫВОДЫ
1. При хронических цереброваскулярных заболеваниях неуклонно прогрессирующий атеросклеротический процесс сопровождается уменьшением скорости кровотока в магистральных артериях головы. При этом изменения линейной систолической скорости кровотока (ЛССК) выявляются при транскраниальной допплерографии на более ранних стадиях как на экстра-, так и на интракраниальном уровне, причем депрессия кровотока изначально возникает и в артериях вертебро-базилярного бассейна, и в каротидном русле. Выявление изменений при допплеровском исследовании предшествует нарастанию симптомов органического поражения нервной системы.
2. Пациенты, перенесшие ишемический инсульт, по сравнению с пациентами с начальными проявлениями церебрального атеросклероза характеризуются высокой частотой гемодинамически значимых стенозов, утолщением комплекса интима-медиа, статистически значимым снижением ЛССК и повышением пульсаторного и индекса периферического сопротивления в отдельных сосудах каротидного и вертебробазиллярного бассейнов с обеих сторон.
3. Структурно-функциональные особенности церебральных сосудов у пациентов, перенесших ишемический атеротромботический инсульт, в позднем восстановительном периоде имеют полушарные особенности. При этом статистически значимая разница в скорости церебрального кровотока наблюдалась только в сосудах каротидного бассейна справа, а индексы сосудистого периферического сопротивления и пульсативности были повышены в разных сосудах обоих бассейнов c двух сторон.