Кардиоцеребральные взаимосвязи и длина теломер на разных стадиях церебрального атеросклероза: миф или факт?
Публикация обновлена: Июль 19
Представление о взаимосвязи кардиальной и церебральной патологии вызывают несомненный интерес у врачей различных специальностей, динамично расширяясь вследствие усовершенствования методов инструментальной диагностики и роста кардиоваскулярной смертности. Изменение функции и структуры сердечной мышцы в ответ на острую и хроническую ишемию головного мозга уже много лет рассматривают в рамках цереброкардиального синдрома - сложного комплекса метаболических, структурных и электрофизиологических сдвигов, возникающих в миокарде по причине нарушения перфузии головного мозга.
Одним из важнейших направлений нейрокардиологии является совершенствование методов диагностики, профилактики и терапии, объединенных кардиальных и церебральных заболеваний. Церебро-кардиальные нарушения, возникающие в остром периоде ишемического инсульта, многогранны. Инсульт с функционально-морфологическим поражением мозга провоцирует кардиальные нарушения (электрическая негомогенность, ишемия миокарда). Установлены полушарные особенности влияния инсульта на функциональное состояние сердечно-сосудистой системы. Степень и характер нарушения функционального состояния сердца у больных инсультом в значительной мере определяет клиническое и прогностическое оформление течения как острого, так и реабилитационного периода. В связи с современными патогенетическими представлениями о механизмах развития ишемического инсульта ранняя диагностика этого заболевания приобретает еще большую значимость. Актуальным на современном этапе становится вопрос об информативности неинвазивных ультразвуковых методов исследования, используемых для изучения состояния мозговых артерий, которые участвуют в кровоснабжении головного мозга [13, 17].
Таким образом, несмотря на сравнительную «молодость» нейрокардиологии как научного направления, определена роль патологии сердца в патогенезе инсульта, изучены некоторые центральные механизмы нервной регуляции деятельности сердца и особенности кардиоцеребральных взаимосвязей в острый период инсульта. Однако до настоящего времени не представлены динамические механизмы формирования особенностей цереброкардиальных взаимосвязей у больных при различных стадиях церебрального атеросклероза.
Цель настоящей работы
Выявить наличие взаимосвязей между показателями вариабельности ритма сердца (ВРС), структурно-функционального состояния сердца и церебральных сосудов, длиной теломер и активностью теломеразы у пациентов с церебральным атеросклерозом (ЦА) 1-3 стадии.
Материалы и методы
В комплексном клинико-инструментальном исследовании приняли участие 229 пациентов с ЦА 2–3-й степени. Диагноз «Церебральный атероскле- роз» формулировался в соответствии с классификацией атеросклероза Всемирной организации здравоохранения от 2015 года и подтверждался данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга). На первом этапе пациенты были разделены на 2 группы: І –– с ЦА 1–2-й степени (без ИИ – группа сравнения); ІI – общая группа пациентов, перенесших ишемический атеротромботический инсульт. В дальнейшем в сравнении групп участвовали пациенты от 55 до 75 лет (таблица 1).
Таблица 1 Демографические показатели у больных с ЦА 1-3 степени
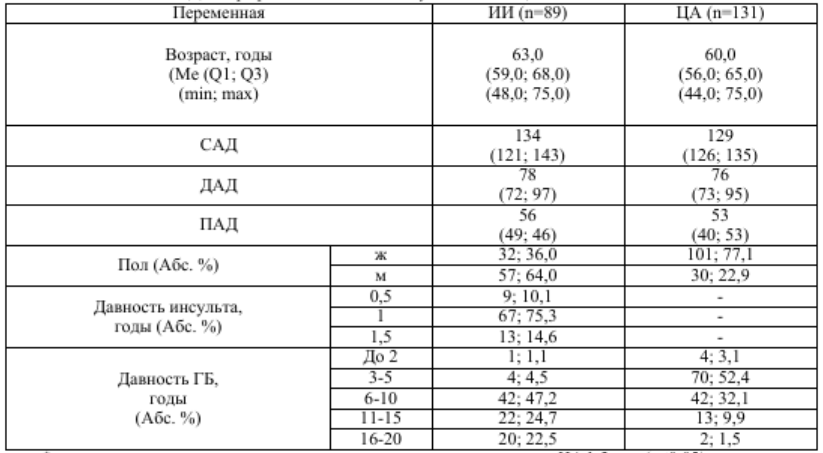
* – существует статистически значимая разница по сравнению с ЦА 1-2 ст. (p≤0,05)
Дизайн исследования: простое, проспективное, нерандомизированное, с последовательным включением пациентов. Проводилось на базе отдела сосудистой патологии головного мозга ГУ «Институт геронтологии имени Д. Ф. Чеботарева НАМН Украины», г. Киев.
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с некоррегируемым артериальным давлением (АД) > 160/90 мм рт. ст., другими нарушениями ритма, требующими проведения антиаритмической терапии, снижением ФВ < 40 % по данным двухмерной эхо- кардиографии (ЭхоКГ), клинически выраженной сердечной недостаточностью, значительно выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. В исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и пороками сердца.
Все пациенты подписывали информированное согласие на участие в исследовании, которое было одобрено этическим комитетом ГУ «Институт геронтологии имени Д. Ф. Чеботарева НАМН Украины» от 11 января 2016 г.
Все пациенты проходили общепринятое клиническое, лабораторное (общий анализ крови и мочи, определение липидного профиля, уровня креатинина, мочевины, глюкозы, аспартатаминотранс- феразы, аланинаминотрансферазы, билирубина) и инструментальное исследование (трансторакальная ЭхоКГ, электрокардиография (ЭКГ), МРТ головного мозга).
Исследование ВРС проводилось на аппарате Schiller AT-10 plus (Швейцария) с использованием статистического анализа временной области и спектрального анализа короткой (пятиминутной) последовательности электрокардиографических интервалов R–R в состоянии покоя. Больным про- водилось комплексное исследование, включающее дуплексное сканирование магистральных артерий головы и шеи без предварительной под- готовки в положении пациента лежа на спине и сидя на приборе Aplio XG (Toshiba) линейным датчиком, работающим в частотном диапазоне 7,0–10,0 МГц. Исследовались следующие гемодинамические параметры: линейная систолическая скорость кровотока (ЛССК). Эхокардиографические исследования проведены на аппарате «Aplio 300» («Toshiba», Япония) с использованием фазированного датчика PST-30BT 3МГц, в соответствии с рекомендациями европейского кардиологического общества. Рассчитывались индексы КСО и КДО (иКСО, иКДО), а также, фракцию выброса ЛЖ (ФВ), масса миокарда ЛЖ (ММЛЖ) и индекс ММЛЖ (иММЛЖ). Для оценки геометрии ЛЖ рассчитывали индекс относительной толщины стенок ЛЖ (иОТСЛЖ) [8]. Диастолическая функция ЛЖ оценивалась по максимальной скорости раннего (Е) и позднего (А) наполнения ЛЖ и их соотношения (Е/А) [10].
На втором этапе из 229 пациентов были выбраны 84 пациента, которым помимо вышеперечисленных исследований, проводили измерение длины теломер и активности теломеразы.
Сбор и хранение образцов крови. Образцы крови отбирали в вакутайнеры, содержащие ЭДТА. На протяжении 30 минут после забора крови производилось выделение мононуклеарных клеток периферической крови на градиенте (1.077г/см3). После выделения клетки замораживались и хранились в жидком азоте при -196°C. Выделение ДНК производили из размороженных клеток, используя метод фенол-хлороформной очистки [14]. Контроль чистоты, концентрации и целостности ДНК проводили с помощью спектрофотомерии и агарозного гель-электрофореза. Относительные длины теломер (ОДТ) измеряли с помощью мультиплексной количественной полимеразой цепной реакцией в реальном времени (RT-qPCR – кПЦР-РВ) [4]. Теломеразную активность определяли с помощью протокола амплификации тандемных повторов с детекцией в реальном времени (ПАТП-РВ) [2].
Для представления результатов в случае количественных переменных рассчитывали среднее значение показателя и его среднеквадратическое отклонение (±SD) в случае нормального закона распределения либо медианное значение показателя (Me) и значения первого (QI) и третьего (QIII) квартилей в случае закона распределения, отличного от нормального. Проверку распределения на нормальность проводили с использованием критерия Ша- пиро-Уилка. Для представления качественных при- знаков рассчитывали их частоту (%). При проведении сравнения количественных показателей в двух группах использованы t-критерий (в случае нормального закона распределения), критерий Манна- Уитни (в случае закона распределения, отличного от нормального). При проведении сравнения качественных показателей использован точный критерий Фишера. Критический уровень значимости во всех случаях р<0,05.
Результаты:
Анализируемые группы были сопоставимы по возрасту, полу и уровням систолического АД (САД), диастолического АД (ДАД), пульсового АД (ПАД) (табл. 1).
Нами был проведен анализ изменений скоростных показателей (ЛССК), которые в значительной степени определяются функциональным состоянием сосудов. Сравнительная характеристика ЛССК представлена в таблице 2.
Таблица 2 Показатели церебрального кровотока (ЛССК) у пациентов с ЦА 1–2-й степени и перенесших ишемический атеротромботический инсульт (Me (Q1; Q3))
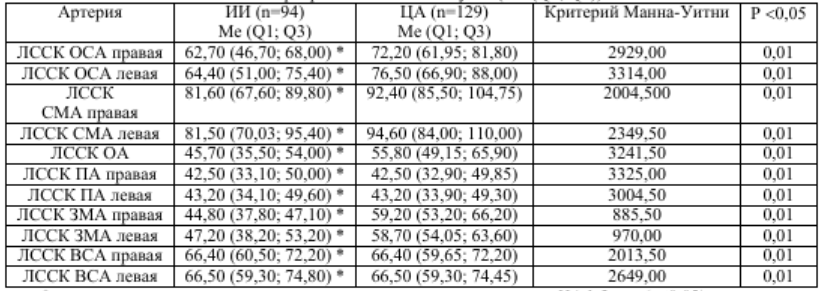
* – существует статистически значимая разница по сравнению с ЦА 1-2 ст. (p≤0,05)
Примечание: ОСА – общая сонная артерия, СМА – среднемозговая артерия, ОА – основная артерия, ВСА – внутренняя сонная артерия, ПА – позвоночная артерия, ЗМА – заднемозговая артерия.
Согласно этим, данным у пациентов с ЦА 1-2 стадии отмечается статистически значимая разница ЛССК в некоторых сосудах каротидного и вертебро-базиллярного бассейнов: в правых и левых ОСА, СМА, ЗМА и в ОА. Так, у пациентов с ЦА 1- 2 стадий ЛССК в правой и левой ОСА и СМА в 1,2 раза выше, чем у пациентов с ИИ; в ОА ЛССК у пациентов с ЦА 1-2 стадии в 1,4 раза выше, чем у пациентов с ИИ, а в правой и левой ЗМА ЛССК выше у пациентов с ЦА 1-2 стадии в 1,3 раза по сравнению с группой постинсультных больных (таб. 2).
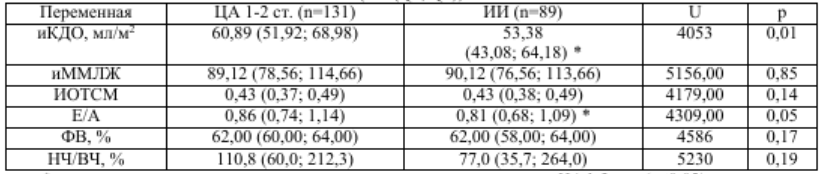
* – существует статистически значимая разница по сравнению с ЦА 1-2 ст. (p≤0,05)
В сравниваемых нами группах также наблюдались статистически значимые отличия при оценке параметров структурно-функционального состояния сердца (таб. 3). Так, у пациентов с ЦА медианные значения иКДО в 1,14 раз больше, чем у пациентов с ИИ. Полагают, что дисфункция вегетативной регуляции сердечно-сосудистой системы влияет на выживаемость после инсульта, поэтому вопросы состояния вегетативного гомеостаза у больных с ишемическим инсультом также привлекают внимание исследователей [3, 6, 9, 11]. Имеется точка зрения, согласно которой отношение НЧ/ВЧ компонентов отражает вагусно-симпатический баланс или симпатические модуляции. Для выявления взаимосвязей между показателями вегетативного баланса, структурно-функционального состояния сердца и церебральных сосудов был проведен корреляционный анализ с расчетом коэффициента ранговой корреляции Спирмена. Так, в общей группе пациентов, перенесших ИИ, установлена прямая корреляционная связь иММЛЖ и иОТСЛЖ с ЛССК в ПА слева (r=0,3) и обратная корреляционная связь иММЛЖ с ЛССК в СМА слева и ЗМА справа (r=-0,3), а также ФВ ЛЖ обратно пропорциональна ЛССК в ВСА слева (r=-0,3) (табл. 4). В группе пациентов с ЦА 1-2 стадии связей наблюдается в 2,5 раза меньше, и они носят абсолютно другой характер. Следует отметить, что если в группе пациентов с ИИ корреляционные связи наблюдались, в основном, ЛССК с основными показателями геометрии и глобальной сократимости ЛЖ, то у пациентов с ДЭ 1-2 стадии ЛССК коррелирует с показателями ВРС и диастолической функции ЛЖ, другими словами, наблюдается некая автономия как церебральной, так и кардиальной гемодинамики (табл.5).
Таблица 4 Значение коэффициента корреляции Спирмена (r) основных показателей структурно-функционального
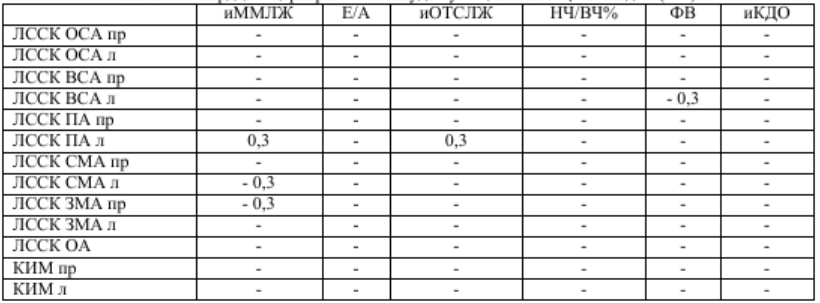
Примечание: в таблице указаны только статистически значимые корреляции (p<0,05)
Таблица 5 Значение коэффициента корреляции Спирмена (r) основных показателей структурно-функционального состояния сердца и церебральных сосудов у пациентов с ЦА 1-2 стадии
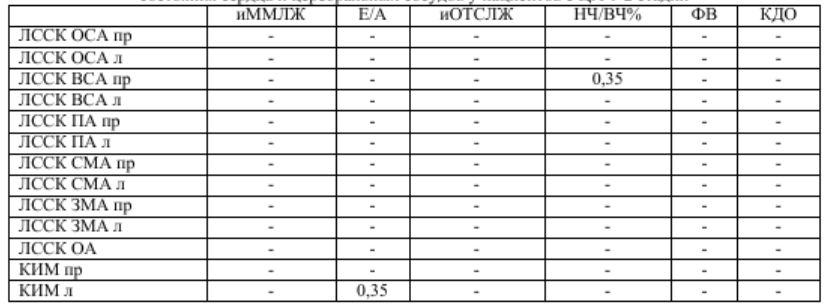
Примечание: в таблице указаны только статистически значимые корреляции (p<0,05)
Но главный наш интерес был в области определения взаимосвязи длины теломер (ДТ) и активности теломеразы с показателями структурнофункционального состояния сердца. В результате проведенного корреляционного анализа установлены прямые связи ДТ с комплексои интима-медии (КИМ) и показателем вегетативного статуса
(НЧ/ВЧ) и обратная связь с диастолической функцией ЛЖ. Причем, активность теломеразы, в отличие от ДТ, имеет обратно пропорциональную зависимость от возраста и никак не связана со структурно-функциональным состоянием сердца и мозга (таб. 8).
Таблица 6 Значение коэффициента корреляции Спирмена (r) основных показателей структурно-функционального состояния сердца и церебральных сосудов и длины теломер, активности теломеразы у пациентов с ЦА 1-3 стадий
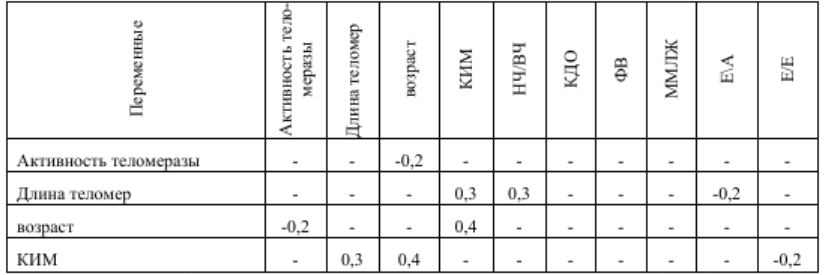
Примечание: в таблице указаны только статистически значимые корреляции (p<0,05)
Обсуждение. При хронических цереброваскулярных заболеваниях неуклонно прогрессирующий атеросклеротический процесс сопровождается уменьшением скорости кровотока в магистральных артериях головы. При этом изменения ЛССК выявляются при транскраниальной допплерографии на более ранних стадиях как на экстра-, так и на интракраниальном уровне, причем депрессия кровотока изначально возникает в 2-х бассейнах: в артериях вертебро-базилярного бассейна и в каротидном русле. Выявление изменений при допплеровском исследовании, в целом, предшествует нарастанию симптомов органического поражения нервной си- стемы. Пациенты, перенесшие ИИ, по сравнению с пациентами с начальными проявлениями ЦА характеризуются утолщением КИМ, статистически значимым снижением ЛССК в отдельных сосудах каротидного и вертебро-базиллярного бассейнов с обеих сторон. Наши выводы согласуются с работами Кузнецовой С. М., Кузнецова В. В., Ены Л.М., Кондратюка В. Е. И соавт, которые ранее в своих публикациях констатировали статистически значимые полушарные изменения церебрального кровотока и их связь с интракардиальной и системной гемодинамикой [14 – 17]. В анализируемой нами группе статистически значимая разница в скорости церебрального кровотока наблюдалась только в сосудах каротидного бассейна справа.
Количество корреляционных связей у пациентов, перенесших ИИ, в 2,5 раза больше, чем у пациентов без ИИ, что косвенно указывает, в первую очередь, на нарушение ауторегуляции мозгового кровотока после ИИ, но также само небольшое количество связей может наталкивать на мысль об отсутствии тесного взаимодействия системы мозг- сердце у данной категории пациентов. Интересно отметить, что взаимосвязь мозгового кровотока с вегетативной нервной системой у постинсультных пациентов вообще не наблюдается, но имеется у пациентов с ЦА 1-2 стадии.
И, наконец, ответ на самый важный вопрос: имеется ли у больных с ЦА разных стадий связь геометрии, массы миокарда и диастолической дисфункции левого желудочка, вегетативной модуляции с длинной теломер – маркером клеточного старения? Да, они связаны, несомненно, но активность теломеразы к этому, вероятно, отношения не имеет, что требует дальнейшего изучения на возможно большей выборке больных.