–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–µ—А–і—Ж–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ —А–∞–Ј–љ—Л—Е —Б—В–∞–і–Є—П—Е —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞
–Я—Г–±–ї–Є–Ї–∞—Ж–Є—П –Њ–±–љ–Њ–≤–ї–µ–љ–∞: –Ш—О–ї—М 19
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤—Л–Ј—Л–≤–∞—О—В –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б —Г –≤—А–∞—З–µ–є —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ—Б—В–µ–є, –і–Є–љ–∞–Љ–Є—З–љ–Њ —А–∞—Б—И–Є—А—П—П—Б—М.
–Ш–Ј–Љ–µ–љ–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Є —Б—В—А—Г–Ї—В—Г—А—Л —Б–µ—А–і–µ—З–љ–Њ–є –Љ—Л—И—Ж—Л –≤ –Њ—В–≤–µ—В –љ–∞ –Њ—Б—В—А—Г—О –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –Є—И–µ–Љ–Є—О –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Г–ґ–µ –Љ–љ–Њ–≥–Њ –ї–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –≤ —А–∞–Љ–Ї–∞—Е —Ж–µ—А–µ–±—А–Њ-–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ вАУ —Б–ї–Њ–ґ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е, —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–і–≤–Є–≥–Њ–≤, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –≤ –Љ–Є–Њ–Ї–∞—А–і–µ –≤ –Њ—В–≤–µ—В –љ–∞ –Њ—Б—В—А—Г—О –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –Є—И–µ–Љ–Є—О –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞.
–¶–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–¶–Т–Ч) вАУ –Њ–і–љ–∞ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –њ—А–Є—З–Є–љ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Б—А–µ–і–Є –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Њ—Б–љ–Њ–≤–Њ–є –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –Љ–Њ–Ј–≥–∞, –њ—А–Є–≤–Њ–і—П—Й–µ–є –Ї —А–∞–Ј–≤–Є—В–Є—О –Њ—Б—В—А—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (–Э–Ь–Ъ), —П–≤–ї—П–µ—В—Б—П –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј [11, 15].
–°–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ, –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј вАУ –Ї–Њ–Љ–њ–ї–µ–Ї—Б —Б–ї–Њ–ґ–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є –Љ–µ–ґ–і—Г —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Њ–є, —Д–Њ—А–Љ–µ–љ–љ—Л–Љ–Є —Н–ї–µ–Љ–µ–љ—В–∞–Љ–Є –Ї—А–Њ–≤–Є —Б —А–∞—Б—В–≤–Њ—А–µ–љ–љ—Л–Љ–Є –≤ –љ–µ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є –Є –ї–Њ–Ї–∞–ї—М–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ (—В—А–Є–∞–і–∞ –Т–Є—А—Е–Њ–≤–∞, 1856 –≥.) [22]. –Т–Њ–Ј–љ–Є–Ї–∞—П –≤ –Њ–і–љ–Њ–Љ —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ –±–∞—Б—Б–µ–є–љ–µ –Є –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—П, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –≤–Њ–≤–ї–µ–Ї–∞–µ—В –Є –і—А—Г–≥–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–µ —Б–Є—Б—В–µ–Љ—Л, –њ—А–Є–≤–Њ–і—П –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П [7, 8]. –°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б —Н–≤–Њ–ї—О—Ж–Є–µ–є –Р–° –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є вАУ —А–∞–Ј—А—Л–≤–∞–Љ–Є, —Д—А–∞–≥–Љ–µ–љ—В–∞—Ж–Є—П–Љ–Є, –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П–Љ–Є –≤ –±–ї—П—И–Ї—Г. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј–∞ –Є–≥—А–∞–µ—В —В–∞–Ї–ґ–µ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А, –њ—А–Њ—П–≤–ї—П—О—Й–Є–є—Б—П –≤ –≤–Є–і–µ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–≥–Њ –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ–Њ—В–Њ–Ї–∞ –Ї—А–Њ–≤–Є –љ–∞ —Б—В–µ–љ–Ї—Г —Б–Њ—Б—Г–і–∞, –љ–∞ –µ–≥–Њ —Н–љ–і–Њ—В–µ–ї–Є–є –≤ –Љ–µ—Б—В–∞—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–≥–Є–±–Њ–≤ –Є –±–Є—Д—Г—А–Ї–∞—Ж–Є–є.
–У–Є–њ–µ—А—В—А–Њ—Д–Є—П –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–У–Ы–Ц) –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —П–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є. –Э–Њ, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –У–Ы–Ц —З–∞—Б—В–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ (–Ш –°), —Д–Є–±—А–Є–ї–ї—П—Ж–Є–µ–є –њ—А–µ–і—Б–µ—А–і–Є–є, –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ (–°–Ф) –Є –¶–Т–Ч. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞–Ї–Њ–њ–Є–ї–Є—Б—М –љ–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –У–Ы–Ц, –Ї–Њ—В–Њ—А—Л–µ —В—А–µ–±—Г—О—В –Њ–±–Њ–±—Й–µ–љ–Є—П. –Т–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Є–Ј—Г—З–∞–ї–Є—Б—М –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В—М –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –У–Ы–Ц [1вАУ5]. –Т –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Є –і–Њ—Б—В–Є–≥–∞–µ—В –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ —Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є 19 % —Г –ї–Є—Ж 17вАУ90 –ї–µ—В [1], –∞ –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є (–Р–У) вАУ 20вАУ50 % [6]. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Љ–∞—Б—Б—Л –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц) –љ–∞ 50 –≥/–Љ –≤ –Є–љ–і–µ–Ї—Б–µ –Љ–∞—Б—Б—Л/–≤—Л—Б–Њ—В—Л –Ы–Ц —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –љ–∞ 50 % [2]. –Я–Њ –і–∞–љ–љ—Л–Љ –њ–∞–љ–µ–ї–Є NHANES II (1976вАУ1992), —Г –ї–Є—Ж —Б –У–Ы–Ц –≤ –і–≤–∞ —А–∞–Ј–∞ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —Б–µ—А–і–µ—З–љ–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –њ–Њ—Б–ї–µ –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Є –љ–∞ –Р–У [3]. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 2461 –±–Њ–ї—М–љ–Њ–≥–Њ, —Г –Ї–Њ—В–Њ—А—Л—Е –і–Є–∞–≥–љ–Њ–Ј –Ш –° –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є, –±–Њ–ї—М–љ—Л–µ —Б –У–Ы–Ц –Є–Љ–µ–ї–Є –љ–∞ 56 % –±–Њ–ї—М—И–µ —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –≤ —В–µ—З–µ–љ–Є–µ —В—А–µ—Е –ї–µ—В, —З–µ–Љ –±–Њ–ї—М–љ—Л–µ –±–µ–Ј –У–Ы–Ц –њ–Њ—Б–ї–µ –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ [4]. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –У–Ы–Ц –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є –Є–ї–Є –≠–Ъ–У –њ—А–µ–і—Б–Ї–∞–Ј—Л–≤–∞—О—В —Б–Љ–µ—А—В–љ–Њ—Б—В—М –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ [5]. –£ –±–Њ–ї—М–љ—Л—Е –Ш –° –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П —Б–≤—П–Ј–∞–љ–∞ —Б –±–Њ–ї—М—И–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є, —З–µ–Љ —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –≥–µ–Њ–Љ–µ—В—А–Є–µ–є. –Ґ–∞–Ї, –≤ –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –Ш –° —А–µ–Ї–Њ–љ—Б—В—А—Г–Є—А–Њ–≤–∞–ї–Є –≥–µ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –Њ–±—А–∞–Ј—Ж—Л –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б–µ—А–і—Ж–∞, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ—А–Є –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –±–Њ–ї—М–љ—Л—Е —Б –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є –У–Ы–Ц –≤—Л—И–µ, —З–µ–Љ –њ—А–Є —Н–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –≥–µ–Њ–Љ–µ—В—А–Є–Є [7]. –†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –±–µ–Ј –Ш –° –њ–Њ–Ї–∞–Ј–∞–ї –њ–Њ–і–Њ–±–љ—Л–є —А–Є—Б–Ї –і–ї—П —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є [8].
–Ю–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –Ї–∞—А–і–Є–Њ–љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є —П–≤–ї—П–µ—В—Б—П —Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є–µ –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є —В–µ—А–∞–њ–Є–Є –Њ–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –¶–µ—А–µ–±—А–Њ-–Ї–∞—А–і–Є–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞, –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–љ—Л. –Ш–љ—Б—Г–ї—М—В —Б —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ-–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Љ–Њ–Ј–≥–∞ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –Ї–∞—А–і–Є–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П (–∞—А–Є—В–Љ–Є–Є, –Є—И–µ–Љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞). –Ю—Б–Њ–±–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ—Л —Н—В–Є –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Б—Г–ї—М—В–∞ –≤ –≤–µ—А—В–µ–±—А–Њ–±–∞–Ј–Є–ї—П—А–љ–Њ–Љ –±–∞—Б—Б–µ–є–љ–µ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –њ–Њ–ї—Г—И–∞—А–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤–ї–Є—П–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°—В–µ–њ–µ–љ—М –Є —Е–∞—А–∞–Ї—В–µ—А –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–µ—А–і—Ж–∞ —Г –±–Њ–ї—М–љ—Л—Е –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Њ—Д–Њ—А–Љ–ї–µ–љ–Є—П —В–µ—З–µ–љ–Є—П –Ї–∞–Ї –Њ—Б—В—А–Њ–≥–Њ, —В–∞–Ї –Є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Г—О ¬Ђ–Љ–Њ–ї–Њ–і–Њ—Б—В—М¬ї –Ї–∞—А–і–Є–Њ–љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –Ї–∞–Ї –љ–∞—Г—З–љ–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П, –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ —А–Њ–ї—М –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і—Ж–∞ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Є–љ—Б—Г–ї—М—В–∞, –Є–Ј—Г—З–µ–љ—Л –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –љ–µ—А–≤–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —Б–µ—А–і—Ж–∞ –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Ї–∞—А–і–Є–Њ—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–µ–є –≤ –Њ—Б—В—А—Л–є –њ–µ—А–Є–Њ–і –Є–љ—Б—Г–ї—М—В–∞. –Ю–і–љ–∞–Ї–Њ –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —Ж–µ—А–µ–±—А–Њ-–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–µ–є —Г –±–Њ–ї—М–љ—Л—Е –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В–∞–і–Є—П—Е —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П:
–Я—А–Њ–≤–µ—Б—В–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–µ—А–і—Ж–∞, –Є–љ—В—А–∞–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ 1вАУ3 —Б—В–µ–њ–µ–љ–Є.
–Ч–∞–і–∞—З–Є:
–°—А–∞–≤–љ–Є—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А—Г–Ї—В—Г—А–љ–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–µ—А–і—Ж–∞, –Є–љ—В—А–∞–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б 1вАУ3 —Б—В–∞–і–Є–µ–є –і–Є—Б—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є.
–Я—А–Њ–≤–µ—Б—В–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–µ—А–і—Ж–∞, –Є–љ—В—А–∞–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В, —Б —Г—З–µ—В–Њ–Љ –њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Т –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –Ї–ї–Є–љ–Є–Ї–Њ-–Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 229 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ 2вАУ3 —Б—В–µ–њ–µ–љ–Є. –Ф–Є–∞–≥–љ–Њ–Ј вАЬ—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–ЈвАЭ —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–ї—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Т–Ю–Ч –Њ—В 2015 –≥. –Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї—Б—П –і–∞–љ–љ—Л–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (—Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є, –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞).
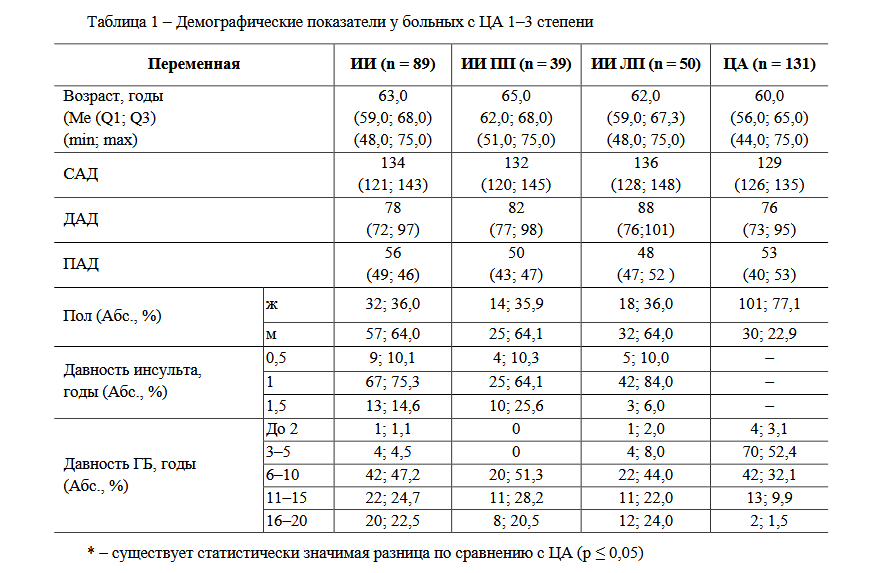
–Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 4 –≥—А—Г–њ–њ—Л: 1 вАУ –њ–µ—А–µ–љ–µ—Б—И–Є–µ –Ш–Ш –≤ –њ—А–∞–≤–Њ–Љ –њ–Њ–ї—Г—И–∞—А–Є–Є (–Я–Я), 2 вАУ –њ–µ—А–µ–љ–µ—Б—И–Є–µ –Ш–Ш –≤ –ї–µ–≤–Њ–Љ –њ–Њ–ї—Г—И–∞—А–Є–Є (–Ы–Я), 3 вАУ —Б —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ 1вАУ2 —Б—В–µ–њ–µ–љ–Є (–±–µ–Ј –Ш–Ш вАУ –≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П) –Є 4 вАУ –Њ–±—Й–∞—П –≥—А—Г–њ–њ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В (–Ш–Ш) (—В–∞–±–ї.1).
–Ф–Є–Ј–∞–є–љ вАУ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ—Б—В–Њ–µ, –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ, –љ–µ—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ, —Б –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л–Љ –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ –±–∞–Ј–µ –Њ—В–і–µ–ї–∞ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –У–£ ¬Ђ–Ш–љ—Б—В–Є—В—Г—В –≥–µ—А–Њ–љ—В–Њ–ї–Њ–≥–Є–Є –Є–Љ–µ–љ–Є –Ф. –§. –І–µ–±–Њ—В–∞—А–µ–≤–∞ –Э–Р–Ь–Э –£–Ї—А–∞–Є–љ—Л¬ї –≥. –Ъ–Є–µ–≤.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ –≤—Б–µ–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є, —Б –љ–µ–Ї–Њ—А—А–Є–≥–Є—А—Г–µ–Љ—Л–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ (–Р–Ф) > 160/90 –Љ–Љ —А—В.—Б—В., –і—А—Г–≥–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞, —В—А–µ–±—Г—О—Й–Є–Љ–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞ (–§–Т) < 40 % –њ–Њ –і–∞–љ–љ—Л–Љ –і–≤—Г—Е–Љ–µ—А–љ–Њ–є –≠—Е–Њ–Ъ–У, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –Є –њ–µ—З–µ–љ–Є, —Б –љ–∞—А–Ї–Њ—В–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М—О, –њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л–Љ–Є –Њ—Б—В—А—Л–Љ–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–≥–Њ –Љ–µ—Б—П—Ж–∞, –∞ —В–∞–Ї–ґ–µ, –њ–µ—А–µ–љ–µ—Б—И–Є–Љ–Є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О, —Б –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ–є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–µ–є –Є–ї–Є –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Њ—А–Њ–Ї–∞–Љ–Є —Б–µ—А–і—Ж–∞.
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–і–њ–Є—Б—Л–≤–∞–ї–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ–і–Њ–±—А–µ–љ–Њ —Н—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ –У–£ ¬Ђ–Ш–љ—Б—В–Є—В—Г—В –≥–µ—А–Њ–љ—В–Њ–ї–Њ–≥–Є–Є –Є–Љ–µ–љ–Є –Ф.–§. –І–µ–±–Њ—В–∞—А–µ–≤–∞ –Э–Р–Ь–Э –£–Ї—А–∞–Є–љ—Л¬ї –Њ—В 11 —П–љ–≤–∞—А—П 2016 –≥.
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Њ—Е–Њ–і–Є–ї–Є –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ, –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–µ (–∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є –Є –Љ–Њ—З–Є –Њ–±—Й–Є–є, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П, —Г—А–Њ–≤–љ—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞, –Љ–Њ—З–µ–≤–Є–љ—Л, –≥–ї—О–Ї–Њ–Ј—Л, –∞—Б–њ–∞—А—В–∞—В–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л, –∞–ї–∞–љ–Є–љ–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л, –±–Є–ї–Є—А—Г–±–Є–љ–∞) –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (—В—А–∞–љ—Б—В–Њ—А–∞–Ї–∞–ї—М–љ–∞—П —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—П, –≠–Ъ–У, —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П —Б–Њ—Б—Г–і–Њ–≤ –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є, –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞) –Є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Б—В–∞–љ–і–∞—А—В–љ—Г—О –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О (–Є–Р–Я–§, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П). –≠—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–µ–і–µ–љ—Л –љ–∞ –∞–њ–њ–∞—А–∞—В–µ ¬ЂAplio 300¬ї (¬ЂToshiba¬ї, –ѓ–њ–Њ–љ–Є—П) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–∞–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–∞—В—З–Є–Ї–∞ PST-30BT 3–Ь–У—Ж, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞.
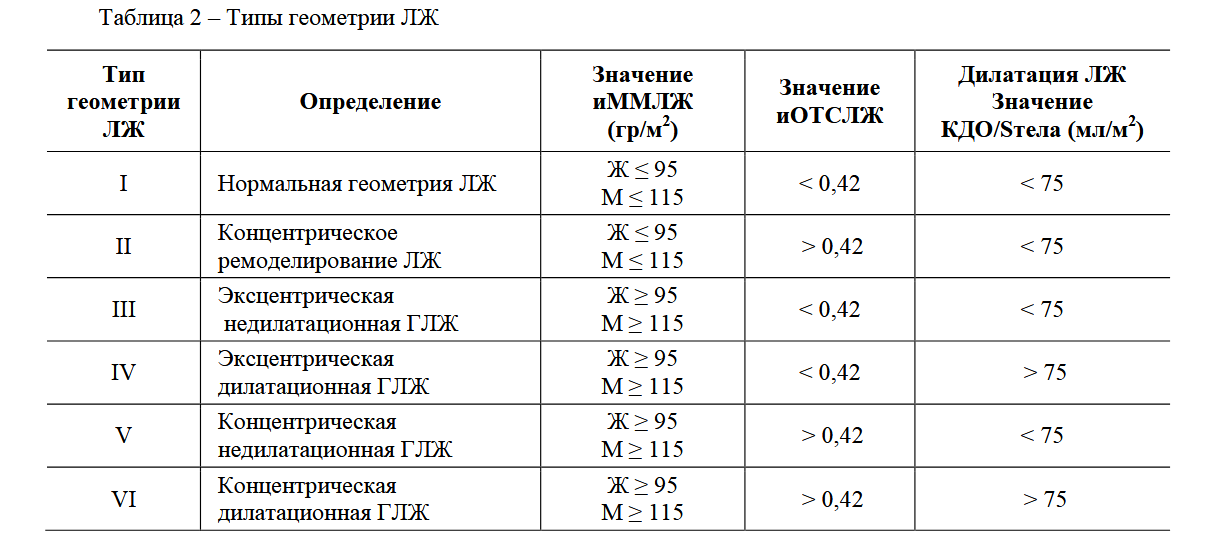
–Ю–њ—А–µ–і–µ–ї—П–ї–Є—Б—М: –Ї–Њ–љ–µ—З–љ–Њ-—Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є —А–∞–Ј–Љ–µ—А (–Ъ–°–†), –Ї–Њ–љ–µ—З–љ–Њ-–і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є —А–∞–Ј–Љ–µ—А (–Ъ–Ф–†), –Ї–Њ–љ–µ—З–љ–Њ-—Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є –Є –Ї–Њ–љ–µ—З–љ–Њ-–і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є –Њ–±—К –Љ—Л —Б–µ—А–і—Ж–∞ (–Ъ–°–Ю, –Ъ–Ф–Ю), —А–∞–Ј–Љ–µ—А –Ы–Я, –њ—А–∞–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Я–Ц), —В–Њ–ї—Й–Є–љ–∞ –Љ–µ–ґ- –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є (–Ь–Ц–Я) –Є –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ч–°–Ы–Ц). –†–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –Є–љ–і–µ–Ї—Б—Л –Ы–Я (–Є–Ы–Я) –Ъ–°–Ю –Є –Ъ–Ф–Ю (–Є–Ъ–°–Ю, –Є–Ъ–Ф–Ю), –∞ —В–∞–Ї–ґ–µ –Ъ–°–† –Є –Ъ–Ф–† (–Є–Ъ–°–†, –Ш–Ъ–Ф–†), —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –Ы–Ц (–§–Т), —Г–і–∞—А–љ—Л–є –Њ–±—К–µ–Љ (–£–Ю), –Љ–∞—Б—Б–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц (–Ь–Ь–Ы–Ц) –Є –Є–љ–і–µ–Ї—Б –Ь–Ь–Ы–Ц (–Є–Ь–Ь–Ы–Ц). –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –≥–µ–Њ–Љ–µ—В—А–Є–Є –Ы–Ц —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є –Є–љ–і–µ–Ї—Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є —В–Њ–ї—Й–Є–љ—Л —Б—В–µ–љ–Њ–Ї –Ы–Ц (–Є–Ю–Ґ–°–Ы–Ц) —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –≥–µ–Њ–Љ–µ—В—А–Є–Є, –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П, –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –Є —Н–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є [8] –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —В–Є–њ–Њ–≤ –≥–µ–Њ–Љ–µ—В—А–Є–Є –Ы–Ц —Б–Њ–≥–ї–∞—Б–љ–Њ ¬ЂPrevalence and determinants of left ventricular geometric abnormalities in hypertensive patients¬ї Hellenic Journal of Cardiology, 2017 (—В–∞–±–ї.2)
–Ф–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–∞—П —Д—Г–љ–Ї—Ж–Є—П –Ы–Ц –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є —Б–Ї–Њ—А–Њ—Б—В–Є —А–∞–љ–љ–µ–≥–Њ (–Х) –Є –њ–Њ–Ј–і–љ–µ–≥–Њ (–Р) –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –Ы–Ц –Є –Є—Е —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П (–Х/–Р), –≤—А–µ–Љ–µ–љ–Є –Ј–∞–Љ–µ–і–ї–µ–љ–Є—П —Б–Ї–Њ—А–Њ—Б—В–Є —А–∞–љ–љ–µ–≥–Њ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –Ы–Ц (DT) –Є –≤—А–µ–Љ–µ–љ–Є –Є–Ј–Њ–≤–Њ–ї—О–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц (IVRT). –†–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Њ—Б—М –Њ—В–љ–Њ—И–µ–љ–Є–µ –њ–Є–Ї–∞ –Х –Ї –њ–Є–Ї—Г –ХвАЩ, —Б–Ї–Њ—А–Њ—Б—В–Є –і–≤–Є–ґ–µ–љ–Є—П —Д–Є–±—А–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞ –Љ–Є—В—А–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞–њ–∞–љ–∞ (–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –Є–ї–Є –Љ–µ–і–Є–∞–ї—М–љ–Њ–є –µ–≥–Њ —З–∞—Б—В–µ–є) вАУ E/–ХвАЩ. –£–≤–µ–ї–Є—З–µ–љ–Є–µ E/–ХвАЩ > 8 —Г—Б–ї. –µ–і. –Њ—В—А–∞–ґ–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ –і–∞–≤–ї–µ–љ–Є—П –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –Ы–Ц, –Ј–љ–∞—З–µ–љ–Є—П > 15 —Г—Б–ї. –µ–і. —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Љ–∞—А–Ї–µ—А –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є [9]. –Э–∞–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ —Б–ї–µ–і—Г—О—Й–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П —В–Є–њ–Њ–≤ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц: E/A вЙ§ 0,8 E/–ХвАЩ вЙ§ 8, DT > 200 –Љ—Б вАУ I —Б—В.; E/A вАУ 0,8вАУ 1,5 E/–ХвАЩ вАУ 9вАУ12, DT вАУ 160вАУ 200 –Љ—Б вАУ I–Ж —Б—В.; E/A > 2, E/–ХвАЩ > 12, DT < 160 –Љ—Б вАУ III —Б—В. [10].
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ —В–∞–Ї –Ї–∞–Ї —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ –≥—А—Г–њ–њ–µ –љ–µ –њ–Њ–і—З–Є–љ—П–µ—В—Б—П –Ј–∞–Ї–Њ–љ—Г –У–∞—Г—Б—Б–∞ (–њ—А–Њ–≤–µ—А–Ї–∞ –Љ–µ—В–Њ–і–Њ–Љ –Ъ–Њ–ї–Љ–Њ–≥–Њ—А–Њ–≤–∞вАУ–°–Љ–Є—А–љ–Њ–≤–∞). –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –і–≤—Г—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≥—А—Г–њ–њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Ї—А–Є—В–µ—А–Є–є –Ї—А–Є—В–µ—А–Є–є –Ь–∞–љ–љ–∞вАУ–£–Є—В–љ–Є вАУ U). –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≤–Є–і–µ –Љ–µ–і–Є–∞–љ—Л –Є 25 %, 75 % –Ї–≤–∞—А—В–Є–ї–µ–є вАУ Me (Q1; Q3).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
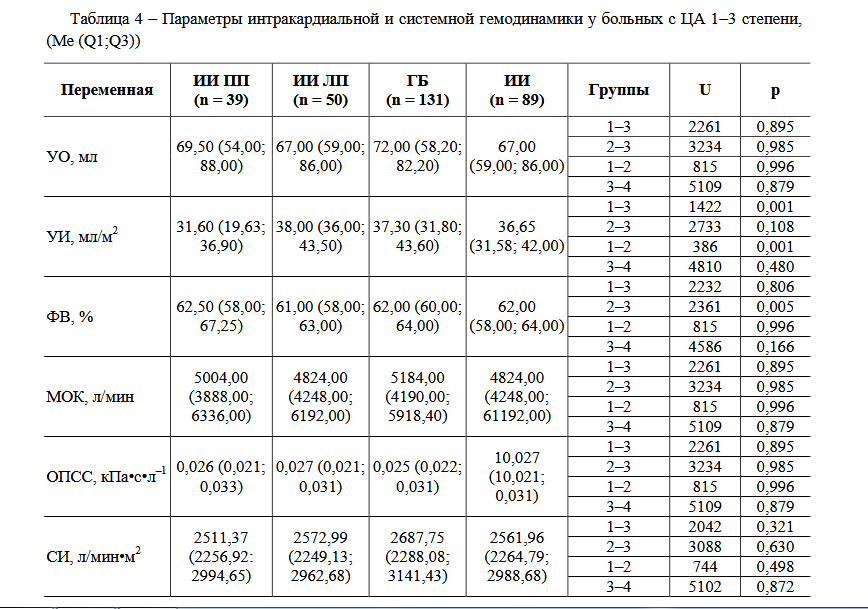
–Р–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г –Є —Г—А–Њ–≤–љ—П–Љ –°–Р–Ф, –Ф–Р–Ф, –Я–Р–Ф. –°—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–µ –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –≥—А—Г–њ–њ—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –Є–Ы–Я –Є —В–Њ–ї—Й–Є–љ–µ —Б—В–µ–љ–Њ–Ї –Ы–Ц (—В–∞–±–ї. 3). –Ґ–∞–Ї, –љ–∞–Є–±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Ы–Я –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р (–≤ 1,1 —А–∞–Ј –±–Њ–ї—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш). –Ь–Є–љ–Є–Љ–∞–ї—М–љ–∞—П —В–Њ–ї—Й–Є–љ–∞ –Ь–Ц–Я –Є –Ч–°–Ы–Ц –±—Л–ї–∞ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р (–≤ 1,18 –Є 1,17 —А–∞–Ј –Љ–µ–љ—М—И–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш –±–µ–Ј —Г—З–µ—В–∞ –њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Ш–Ю). –Ь–µ–ґ–њ–Њ–ї—Г—И–∞—А–љ—Л–µ –Њ—В–ї–Є—З–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —В–Њ–ї—Й–Є–љ—Л –Ь–Ц–Я. –Ґ–∞–Ї, –Ь–Ц–Я–і –±—Л–ї–∞ –≤ 1,15 —А–∞–Ј —В–Њ–ї—Й–µ –≤ –≥—А—Г–њ–њ–µ –Ш–Ш —Б –њ—А–∞–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є, —З–µ–Љ —Б –ї–µ–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Ш–Ю.
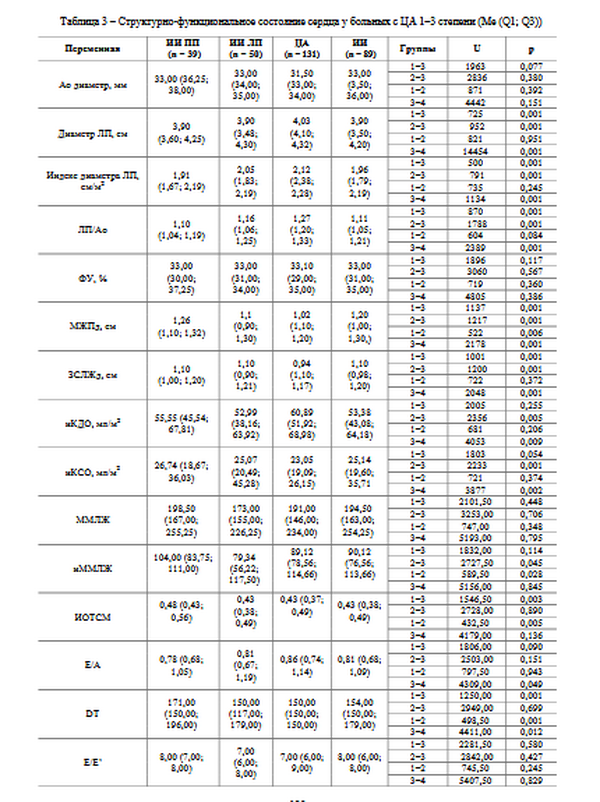
–Т —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –љ–∞–Љ–Є –≥—А—Г–њ–њ–∞—Е —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –Њ—В–ї–Є—З–Є—П –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —Б–Є—Б—В–µ–Љ–љ–Њ–є –Є –Є–љ—В—А–∞–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є (—В–∞–±–ї. 3, 4). –Ґ–∞–Ї, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р –Є–Ъ–Ф–Ю –≤ 1,14 —А–∞–Ј –±–Њ–ї—М—И–µ –Є –Є–Ъ–°–Ю –≤ 1,09 —А–∞–Ј –Љ–µ–љ—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш, –њ—А–Є —Н—В–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Ш–Ю –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –љ–∞–Є–Љ–µ–љ—М—И–∞—П –§–Т –Є –Є–Ъ–Ф–Ю –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р (–≤ 1,02 –Є 1,15 —А–∞–Ј —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ь–µ–ґ–њ–Њ–ї—Г—И–∞—А–љ—Л–µ –Њ—В–ї–Є—З–Є—П –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л —В–Њ–ї—М–Ї–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–µ–ї–Є—З–Є–љ—Л –£–Ш. –Ґ–∞–Ї, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш –≤ –Ы–Я –£–Ш –±—Л–ї –≤ 1,2 —А–∞–Ј–∞ –±–Њ–ї—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш –≤ –Я–Я.
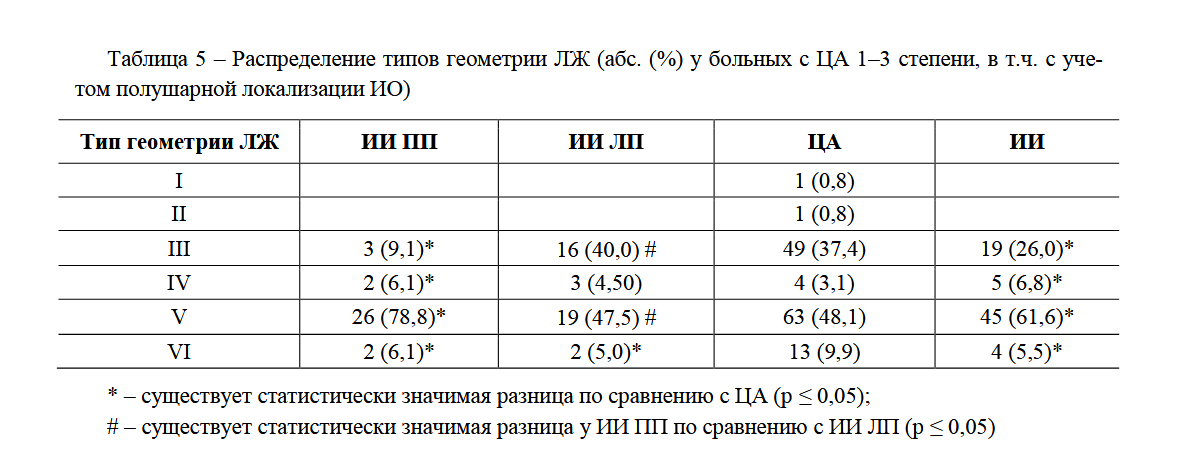
–°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ ¬ЂPrevalence and determinants of left ventricular geometric abnormalities in hypertensive patients¬ї, –њ–∞—Ж–Є–µ–љ—В—Л —Б –Р–У –Є–Љ–µ—О—В 6 —В–Є–њ–Њ–≤ –У–Ы–Ц –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ј–љ–∞—З–µ–љ–Є–є –Є–Ь–Ь–Ы–Ц, –Є–Ю–Ґ–°–Ы–Ц –Є –і–Є–ї–∞—В–∞—Ж–Є–Є –Ы–Ц (—В–∞–±–ї. 4).
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –≤—Л—И–µ–њ—А–Є–≤–µ–і–µ–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є, –≤ –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л—Е –љ–∞–Љ–Є –≥—А—Г–њ–њ–∞—Е –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л: –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р –Є –Ш–Ш —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–∞—П —Н–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –Є –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –У–Ы–Ц (37,4 % –Є 48,1 % вАУ 26,0 % –Є 61,6 % —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –Њ–і–љ–∞–Ї–Њ III —В–Є–њ –≤ 1,44 —А–∞–Ј–∞ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р, –∞ V —В–Є–њ вАУ –≤ 1,28 —А–∞–Ј —З–∞—Й–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш. –≠–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–∞—П –У–Ы–Ц –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш вАУ –≤ 2,2 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р, –∞ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–∞—П –У–Ы–Ц —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –¶–Р вАУ –≤ 1,8 —А–∞–Ј —З–∞—Й–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш (—В–∞–±–ї. 5).
–Ь–µ–ґ–њ–Њ–ї—Г—И–∞—А–љ—Л–µ –Њ—В–ї–Є—З–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є III –Є V —В–Є–њ–Њ–≤ –У–Ы–Ц. –Ґ–∞–Ї, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–∞–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Ш–Ю –≤ 1,66 —А–∞–Ј —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–∞—Б—М –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–∞—П –У–Ы–Ц, –∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Ш–Ю вАУ –≤ 4,4, —А–∞–Ј–∞ —Н–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–∞—П –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–∞—П –У–Ы–Ц.
–Т—Л–≤–Њ–і—Л
1. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ 1вАУ2 —Б—В–µ–њ–µ–љ–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –Њ—В–ї–Є—З–Є—П –Љ–Њ—А—Д–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–µ—А–і—Ж–∞, –Є–љ—В—А–∞–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ–µ—А–µ–љ–µ—Б—И–Є–Љ–Є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В –≤ –њ—А–∞–≤–Њ–Љ –Є –ї–µ–≤–Њ–Љ –њ–Њ–ї—Г—И–∞—А–Є–Є, –њ—А–Є—З–µ–Љ –љ–∞–Є–±–Њ–ї–µ–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –Њ—В–ї–Є—З–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є —В–Є–њ–Њ–≤ –≥–µ–Њ–Љ–µ—В—А–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞.
2. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ 1вАУ2 —Б—В–µ–њ–µ–љ–Є —В–Њ–ї—Й–Є–љ–∞ –Љ–µ–ґ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є –Є –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –±—Л–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ, –∞ –Ї–Њ–љ —Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Є–є –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ—Л–є —В–Є–њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –≤—Б—В—А–µ—З–∞–ї—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ–µ—А–µ–љ–µ—Б—И–Є–Љ–Є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В.
3. –Ф–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В, —Е–∞—А–∞–Ї—В–µ—А–љ—Л –Љ–µ–ґ–њ–Њ–ї—Г—И–∞—А–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≥–µ–Њ–Љ–µ—В—А–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞. –Ґ–∞–Ї, —Н–Ї—Б—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Є–є –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ—Л–є —В–Є–њ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –≤—Б—В—А–µ—З–∞–ї—Б—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ —З–∞—Й–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞ –≤ –ї–µ–≤–Њ–Љ –њ–Њ–ї—Г—И–∞—А–Є–Є, –∞ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Є–є –љ–µ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ—Л–є —В–Є–њ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є вАУ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–∞–≤–Њ–њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞.