Прогнозирование развития ишемического инсульта у пациентов с церебральным атеросклерозом и сахарным диабетом
Публикация обновлена: Июль 18
ВВЕДЕНИЕ
Сахарный диабет 2 типа (СД2) – неинфекционное хроническое заболевание, вызывающее множество осложнений. В основе развития сосудистой патологии мозга при СД2 лежат как атеросклеротическое поражение крупных и мелких церебральных артерий, так и расстройства в системе микроциркуляции [8]. Риск ЦВЗ возрастает у пациента с СД в сочетании с дислипидемией и артериальной гипертензией (АГ).
В частности, повышенный уровень систолического АД у больного с СД в 2-3 раза увеличивает риск инсульта (И) [5]. Кроме того, АГ индуцирует атеросклероз и фибриноидный некроз стенки сосудов, приводя к развитию микроаневризм, которые способствуют разрывам сосудистой стенки [5, 8].
СД является причиной ускоренного старения сосудов. У пациентов с СД риск И примерно в два раза выше по сравнению с недиабетиками. Гипергликемия является ведущим фактором риска неблагоприятного исхода после И, но она может быть просто маркером неблагоприятного исхода, а не причиной. В некоторых исследованиях было показано, что снижение уровня глюкозы не связано с улучшением прогноза И. Точно так же долговременная профилактика риска И у пациентов с СД не дает улучшения только с помощью глюкозоснижающей терапии.
Цереброваскулярная патология и метаболические нарушения – проблемы современного здравоохранения, имеющие колоссальную медико- социальную значимость [1, 8]. Высокий процент не только смертности, но и инвалидизации определяет чрезвычайную актуальность изучения их различных аспектов, а наличие сочетанной патологии требует выработки персонифицированного подхода к тактике ведения таких больных.
Ишемический инсульт (ИИ) – одно из тяжелейших заболеваний. Ежегодно в мире 15 млн. человек переносят инсульт, в результате которого 5 млн. умирают, а 5 млн. утрачивают функциональную состоятельность. Утрата функциональной состоятельности у лиц, перенесших И, обусловливает актуальность проблемы [7, 8]. Одним из перспективных направлений повышения эффективности лечебных мероприятий при ИИ и СД2 является выявление предрасположенности пациентов к И. Прогнозирование вероятного И позволит организовать превентивную терапию, что будет способствовать уменьшению числа больных с ИИ, в частности с СД2.
На сегодняшний день рассматривается множество клинических признаков для стратификации риска возникновения И. Наибольшее распространение получили прогностические системы SCORE и CHADS2, в которых используются такие показатели, как возраст, курение, уровень общего холестерина, артериальное давление и др. [5, 6]. Существующие системы не лишены такого недостатка, как недооценка вероятности развития острых нарушений мозгового кровообращения у пациентов. Мероприятия по превентивной терапии должны учитывать разнообразные факторы риска возникновения ИИ. Возможность предотвращения И обусловлена тем, что многие из факторов риска подлежат коррекции [7, 8]. Для решения этой задачи необходимо оценивать не только структурно-функциональное состояние церебральных сосудов и уровень гликемии натощак, но и структурно-функциональное состояние и вариабельность ритма сердца, и определять их прогностическую значимость [5].
Целью нашего исследования является прогнозирование развития ИИ на основании показателей структурно-функционального состояния сердца и церебральных сосудов и вариабельности ритма сердца у пациентов с церебральным атеросклерозом (ЦА) и СД2.
МАТЕРИАЛЫ И МЕТОДЫ
В комплексном клинико-инструментальном исследовании приняли участие 229 пациентов с ЦА 1-3-й степени. Диагноз «Церебральный атеросклероз» формулировался в соответствии с классификацией атеросклероза Всемирной организации здравоохранения от 2015 года и подтверждался данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга).
Дизайн исследования: простое, проспективное, нерандомизированное, с последовательным включением пациентов.
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с некорригируемым артериальным давлением (АД) >160/90 мм рт. ст., другими нарушениями ритма, требующими проведения антиаритмической терапии, снижением ФВ < 40% по данным двухмерной эхо-кардиографии (ЭхоКГ), клинически выраженной сердечной недостаточностью, значительно выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. Также в исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца.
Все пациенты проходили общепринятое клиническое, лабораторное (общий анализ крови и мочи, определение липидного профиля, уровня креатинина, мочевины, глюкозы, аспартатаминотрансферазы, аланинаминотрансферазы, билирубина) и инструментальное исследование (трансторакальная ЭхоКГ, электрокардиография (ЭКГ), ультразвуковая допплерография сосудов головы и шеи, МРТ головного мозга). Все пациенты принимали антигипертензивные и антидиабетические препараты, антиагреганты, статины.
Эхокардиографические исследования проведены на аппарате «Aplio XG» («Toshiba», Япония) с использованием фазированного датчика PST-30BT 3МГц, в соответствии с рекомендациями европейского кардиологического общества. Определялись: конечно- систолический размер (КСР), конечно-диастолический размер (КДР), конечно- систолический и конечно- диастолический объёмы сердца (КСО, КДО), размер ЛП, правого желудочка (ПЖ), толщина межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ). Рассчитывались индексы ЛП (иЛП) КСО и КДО (иКСО, иКДО), а также КСР и КДР (иКСР, ИКДР), фракция выброса ЛЖ (ФВ), ударный объём (УО), масса миокарда ЛЖ (ММЛЖ) и индекс ММЛЖ (иММЛЖ).
Больным проводилось комплексное исследование, включающее дуплексное сканирование магистральных артерий головы и шеи без предварительной подготовки в положении пациента лежа на спине и сидя на приборе Aplio XG (Toshiba) линейным датчиком, работающим в частотном диапазоне 7,0-10,0 МГц. Исследовались следующие гемодинамические параметры: линейная систолическая скорость кровотока (ЛССК), индекс пульсативности (PI), индекс периферического сопротивления (RI). При оценке состояния кровообращения в артериях Виллизиева круга с помощью транскраниального дуплексного сканирования учитывались следующие параметры: варианты анатомического строения артерий; частота окклюзирующих поражений артерий; функциональное состояние артерий и степень перестройки гемодинамики в артериях Виллизиева круга на стороне инфаркта и противоположной стороне.
Исследование ВРС проводилось на аппарате Schiller AT-10 plus (Швейцария) с использованием статистического анализа временной области и спектрального анализа короткой (пятиминутной ) последовательности электрокардиографических интервалов R–R в состоянии покоя. Определялись следующие показатели временного анализа: стандартное отклонение (SDNN, мс), стандартное отклонение разностей продолжительности соседних интервалов R–R (RMSSD, мс). При выполнении спектрального анализа определялись: общая мощность спектра ритма сердца (tP,мс2), мощности в диапазоне 0,00-0,04 Гц (ОНЧ, мс2), 0,04-0,15 Гц (НЧ, мс2), 0,15-0,4 Гц (ВЧ, мс2) и соотношение НЧ/ВЧ.
Этические аспекты. Протокол исследования был одобрен комитетами по этике ГУ «Институт эндокринологии и обмена веществ имени В. П. Комиссаренко» и ГУ «Институт геронтологии имени Д. Ф. Чеботарева» (оба являются частью Национальной академии медицинских наук Украины). Все участники дали письменное информированное согласие. Хельсинкская декларация (2000 г.) и применимые национальные стандарты, касающиеся их участия в исследованиях, были учтены.
Статистический анализ. Для представления результатов в случае количественных переменных рассчитывалось среднее значение показателя и его среднеквадратическое отклонение (±SD) в случае нормального закона распределения, либо медианное значение показателя (Me) и значения первого (QI) и третьего (QIII) квартилей в случае закона распределения, отличного от нормального. Проверка распределения на нормальность проводилась с использованием критерия Шапиро-Уилка. Для представления качественных признаков рассчитывалась их частота (%). При проведении сравнения количественных показателей в двух группах использован t-критерий (в случае нормального закона распределения), критерий Манна-Уитни (в случае закона распределения, отличного от нормального). При проведении сравнения качественных показателей использован точный критерий Фишера.
Для анализа связи показателя T/S (зависимая переменная) с факторными признаками использовался метод построения и анализа логистической регрессии. Показатель отношения шансов (OR) и его 95% доверительный интервал (95% CI) рассчитывался для оценки степени связи между зависимой и независимыми переменными [1]. Для анализа адекватности моделей регрессии был проведен ROC-анализ [1], была рассчитана площадь под кривой операционных характеристик (AUC). Порог значимости во всех случаях был установлен на уровне р <0,05.
Статистический анализ был выполнены MedCalcv.18.10 (MedCalc Software Inc., Broekstraat, Бельгия,1993-2018).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
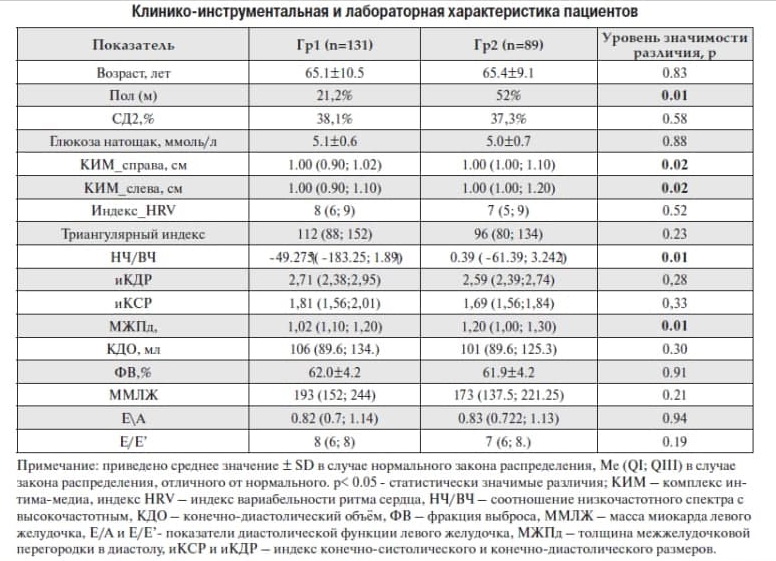
Пациенты были разделены на 2 группы: І – с ЦА 1-2-й степени, ІІ – с ЦА 3 степени (перенесшие ишемический атеротромботический инсульт (ИИ)) (таблица 1). Средний возраст = 65.1±10.5 и 65.4±9.1 лет, соответственно. Доля мужчин составила 21,2% в 1-й и 52% во 2-й группах. Количество пациентов с СД 2 типа, средний уровень глюкозы натощак и гликозилированного гемоглобина были сопоставимы в обеих группах. У всех пациентов на момент обследования было достигнуто целевое значение АД и компенсация СД2.
Величина КИМ с обеих сторон была значимо (p<0.05) больше у пациентов 2-й группы. При этом пациенты двух групп не различались по показателям структурно-функционального состояния сердца: ФВ, ММЛЖ, КДО и показатели диастолической функции сердца были сопоставимы. Показатель НЧ/ВЧ отражает состояние симпато-парасимпатического баланса ВНС. Большие значения этого показателя свидетельствуют о преобладании тонуса симпатического отдела ВНС, что статистически значимо наблюдалось у пациентов 1-й группы, при этом триангулярный индекс и индекс HRV, применяемые для оценки общей ВРС были сопоставимы в обеих группах и выше нормальных международных значений.
Таблица 1
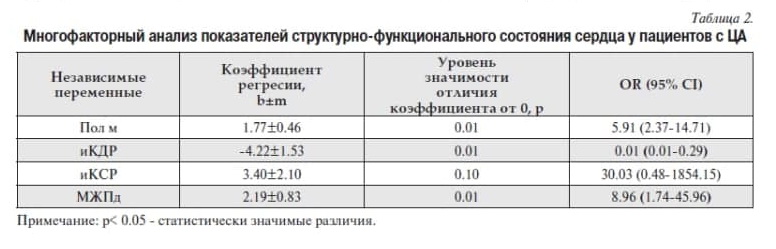
Для выявления факторов, влияющих на развитие инсульта в общей когорте пациентов, использовался метод построения логистических моделей регрессии [3]. Важно учитывать и тот факт, что именно комбинация факторов риска, а не каждый отдельный фактор риска по отдельности, может приводить к развитию инсульта. Для отбора совокупности значимых факторов риска использовался метод пошагового включения/исключения признаков (Stepwise при пороге исключения p>0.15 и пороге включения p<0.03). На выделенных значимых факторах риска была построена многофакторная модель логистической регрессии, в которую вошли показатели, представленные в таблице 2. Была также установлена статистически значимая положительная связь инсульта с полом и МЖПд, а также отрицательная связи с иКДР.
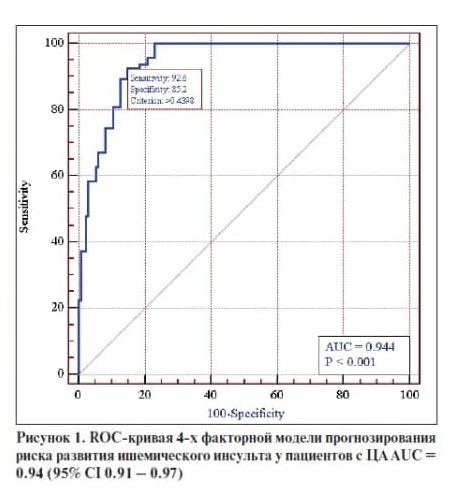
Выявлена хорошая согласованность выделенных факторных признаков с риском развития ишемического инсульта – AUC=0.94 (CI 0.91 – 0.97) (рис.1), что может указывать на полноту модели и предикторов инсульта, рассмотренных в данном исследовании. Все представленные в таблице 3 показатели являются весомыми в общей многофакторной модели, хотя статистической значимости для некоторых получено не было.
Для выявления факторов, влияющих на развитие инсульта у пациентов с СД2, была построена отдельно логистическая модель регрессии. Алгоритм построения модели использовался такой же, как и в общей группе пациентов с ЦА. На выделенных значимых факторах риска была построена многофакторная модель логистической регрессии, в которую вошли показатели, представленные в таблице 3. Была также установлена статистически значимая положительная связь инсульта с уровнем глюкозы натощак и толщиной КИМ, а также отрицательная связи с показателем диастолической функции ЛЖ Е/А.
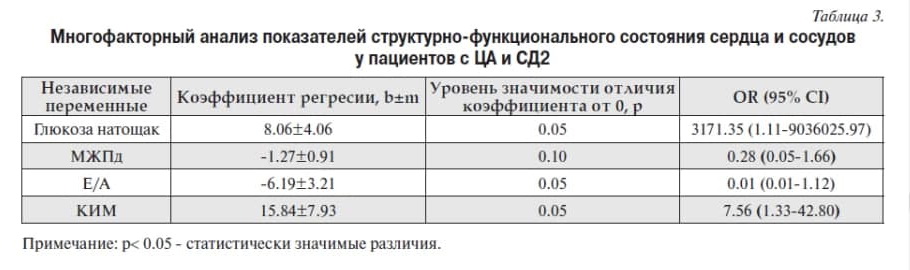
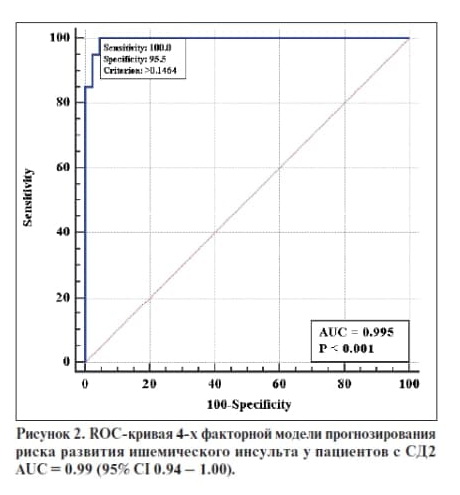
Выявлена хорошая согласованность выделенных факторных признаков с риском развития ишемического инсульта – AUC=0.99 (CI 0.94 – 1.00) (рис.2), что может указывать на полноту модели и предикторов инсульта, рассмотренных в данном исследовании. Все представленные в таблице 3 показатели являются весомыми в общей многофакторной модели, хотя статистической значимости для некоторых получено не было. Вероятно, необходим больший размер выборки.
Клинические работы, изучающие взаимосвязь структурно-функционального состояния сердца и сосудов, ВРС с развитием ИИ малочисленны. Так, в публикации В. Кондратюка, Л. Ены было продемонстрировано, что пациенты, перенесшие ИИ, по сравнению с пациентами с АГ без ИИ характеризуются более выраженной ГЛЖ, большими размерами полостей сердца и снижением систолической функции ЛЖ, однако авторы не изучали влияние показателей структурно функционального состояния сердца на прогноз развития ИИ [2].
И.Е. Каленова и соавт. [1] с использованием дискриминантного анализа предложили методику оценки вероятности возникновения инсульта в течение 3-х лет у пожилых больных АГ в сочетании с ИБС, СД2 и ожирением на основании совокупности синдромов и сопутствующих осложнений (ФП, нарушение гемостаза и т.д.), но непосредственно показатели структурно-функционального состояния сердца в их анализ не входили.
КИМ общей сонной артерии является надежным маркером атеросклеротического процесса. По данным ряда авторов, утолщение КИМ общей сонной артерии на 0,16 мм повышает риск возникновения инсульта в 1,6 раза, существует и обратная зависимость скорости кровотока от степени стеноза артерии [4]. Необходимо отметить, что в нашу модель прогнозирования ИИ в общей когорте пациентов с ЦА методом логистической регрессии КИМ не вошел, а у пациентов с СД2 напротив имеет ключевое значение.
Важно отметить тот факт, что в большом систематическом обзоре и мета-анализе, проведенным Mohammad Ziaul Islam Chowdhury et al. [5], представлены данные 26202 публикаций (до 22 апреля 2019 включительно баз PubMedб EMBASE и MedLINE), в которых изучались предикторы ИИ у пациентов с СД2. Выводы этого мета-анализа остаются обнадеживающими для последующих исследователей: модели прогнозирования, по мнению авторов, неудовлетворительны и требуют введения новых показателей для улучшения валидации.
В проведенном нами исследовании для пациентов с ЦА была установлена отрицательная связь ИИ с иКДР и положительные связи с толщиной МЖПд и мужским полом, что логично объясняет важную роль геометрии ЛЖ в развитии ИИ. Для пациентов с СД2 была установлена отрицательная связь ИИ с показателем диастолической функции ЛЖ и положительные – с уровнем глюкозы натощак и толщиной КИМ.
ВЫВОДЫ
На основании многофакторного регрессионного анализа у пациентов с ЦА с развитием ИИ выявлено наличие связи толщины МЖПд, иКСР, иКДР и мужского пола (AUC=0.94 (CI 0.91 – 0.97), а у пациентов с СД2 и ЦА - уровня глюкозы натощак, толщины МЖПд, толщины КИМ и Е/А AUC = 0.99 (95% CI 0.94 – 1.00) .