Возрастные и половые различия мозгового кровообращения у пациентов с церебральным атеросклерозом и сахарным диабетом
Публикация обновлена: Июль 18
Сахарный диабет 2-го типа (СД2) – неинфекционное хроническое заболевание, вызывающее множество осложнений. В основе развития сосудистой патологии мозга при СД2 лежат как атеросклеротическое поражение крупных и мелких церебральных артерий, так и расстройства в системе микроциркуляции [8]. Риск развития цереброваскулярных заболеваний (ЦВЗ) возрастает у пациента с СД в сочетании с дислипидемией и артериальной гипертензией (АГ). В частности, повышенный уровень систолического артериального давления (АД) у больного СД в 2–3 раза увеличивает риск инсульта (И) [5]. Кроме того, АГ индуцирует атеросклероз и фибриноидный некроз стенки сосудов, приводя к развитию микроаневризм, которые способствуют разрывам сосудистой стенки [5, 8].
СД является причиной ускоренного старения сосудов. У пациентов с СД риск И примерно в два раза выше по сравнению с недиабетиками. Гипергликемия является ведущим фактором риска неблагоприятного исхода после И, но она может быть просто маркером неблагоприятного исхода, а не причиной. В некоторых исследованиях было показано, что снижение уровня глюкозы не связано с улучшением прогноза И. Точно так же долговременная профилактика риска И у пациентов с СД не дает улучшения только с помощью глюкозоснижающей терапии.
Цереброваскулярная патология и метаболические нарушения – проблемы современного здравоохранения, имеющие колоссальную медико-социальную значимость [1, 8]. Высокий процент не только смертности, но и инвалидизации определяет чрезвычайную актуальность изучения их различных аспектов, а наличие сочетанной патологии требует выработки персонифицированного подхода к тактике ведения таких больных.
С каждым годом статистика констатирует рост показателей заболеваемости и смертности от сердечно-сосудистых заболеваний и в первую очередь таких, как ишемический инсульт и инфаркт миокарда. Следует отметить, что заболеваемость и смертность от инсульта в Украине значительно выше, чем в странах Европы и США. Среди всех нарушений мозгового кровообращения (НМК) ишемические инсульты диагностируются в 75–80% случаев [1, 2, 19]. Наиболее частой причиной тромбоокклюзирующего поражения сосудистой системы мозга является атеротромбоз - генерализованный и прогрессирующий процесс, зависящий от эволюции атеросклеротических изменений в сосудах.
Согласно современной концепции атеросклероза и атеротромбоза, клиническая манифестация большинства сердечно-сосудистых катастроф непосредственно связана с моментом нарушения целостности атеросклеротической бляшки [3, 4]. Принципиально важным звеном патогенеза атеросклероза и его осложнений (атеростеноз, атеротромбоз, атероэмболия, атероокклюзия, кровоизлияния в бляшку с последующей тромбоэмболией) является эндотелиальная дисфункция. Эндотелий (внутренняя выстилка сосудов) состоит приблизительно из 1,6×1013 клеток общим весом около 1 кг и общей площадью около 900 м2. Эндотелиоциты имеют выраженную метаболическую активность и выполняют различные функции. Именно поэтому эндотелий, по сути, может рассматриваться как самая большая эндокринная железа. Эндотелий является не только органом-мишенью, но и эффектором при различной сердечно-сосудистой патологии:
– вырабатывая различные биологически активные вещества,
– принимает самое активное участие в поддержании сосудистого тонуса, атеромбогенности сосудистой стенки, регуляции адгезии и агрегации тромбоцитов,
– проявляет про- и антикоагулянтную, фибринолитическую активность,
– участвует в процессах воспаления [5–7, 18].
Этапы эволюции атеросклеротической бляшки ассоциированы с эндотелиальной дисфункцией. Дисфункция эндотелия, согласно наиболее современной гипотезе, развивается вследствие хронического его повреждения, что приводит к адгезии тромбоцитов к субэндотелиальному слою и их агрегации, высвобождению факторов роста, способствующих миграции гладкомышечных клеток из медии в интиму с образованием фиброзных бляшек.
Важную роль в механизмах атерогенеза играет также гемодинамический фактор, проявляющийся в виде повреждающего локального воздействия потока крови на стенку сосуда, на его эндотелий в местах физиологических изгибов и бифуркаций. Процесс формирования атеротромботического поражения сосуда сложен, многокомпонентен и зачастую очень длителен. Атеротромбоз артерий головы, также как и атеротромбоз в других сосудистых бассейнах, начинается с дестабилизации атеросклеротической бляшки, которая за счет пристеночного тромбообразования может увеличиваться в объеме, приводя к полной закупорке просвета артерии.
Таким образом, исходом атеросклеротического поражения сосудистой системы мозга может быть развитие ишемических НМК. Вместе с тем достаточно долго – годы, порой десятилетия процесс может быть клинически асимптомным. При каких обстоятельствах и что может послужить причиной клинической манифестации асимптомного поражения внутренней сонной артерии (ВСА), иначе говоря, чем и когда инициируется атеросклеротическая бляшка, превращаясь в агрессивную и потенциально опасную в плане возникновения НМК – является предметом активной дискуссии.
Имеются противоречивые сообщения о значении степени стеноза ВСА как фактора риска развития ишемического инсульта. Некоторые авторы придерживаются мнения, что угроза развития ишемических НМК в значительной степени зависит не только от степени стеноза ВСА, но и от строения атеросклеротической бляшки. Исследование связи между степенью стеноза и частотой развития инсульта показало их прямую зависимость – так, при стенозах гомолатеральной ВСА выраженностью более 90% частота развития инсульта достигает 32–35% [8, 9]. По данным других авторов, 37% инсультов сочетались с эхонегативными (гипоэхогенными по данным ультразвуковой диагностики) атеросклеротическими бляшками ВСА, тогда как наличие гетерогенных атеросклеротических бляшек определялось лишь у 18% пациентов с инсультом [10]. Выделены морфологические особенности бляшки, которые могут иметь значение в повышении риска развития инсульта: ее величина (то есть степень стеноза), состояние поверхности (гладкая или с изъязвлениями), гистологическая структура (отложения липидов и атероматозных масс, фиброз, обызвествления, геморрагии) [11, 12].
Широкое внедрение новейших методов нейровизуализации, в том числе ультразвуковых исследований, позволило увеличить степень выявляемости атеросклеротического процесса в сосудах мозга, а также процент их асимптомного поражения.
В связи с современными патогенетическими представлениями о механизмах развития ишемического инсульта ранняя диагностика этого заболевания приобретает еще большую
значимость. Актуальным на современном этапе становится вопрос об информативности неинвазивных ультразвуковых методов исследования, используемых для изучения состояния мозговых артерий, которые участвуют в кровоснабжении головного мозга [13, 17, 20].
Цель исследования: определение половых и возрастных различий структурно-функционального состояния сосудов каротидного и вертебро-базиллярного бассейнов у пациентов с ЦА І–ІІІ стадии и СД2 .
МАТЕРИАЛЫ И МЕТОДЫ
В комплексном клинико-инструментальном исследовании приняли участие 229 пациентов с ЦА І–ІІІ стадии и СД2. Диагноз «Церебральный атеросклероз» устанавливали в соответствии с классификацией атеросклероза Всемирной организации здравоохранения от 2015 года и подтверждали данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга).
Пациенты были разделены на две группы:
-
І группа – общая группа пациентов, перенесших ишемический атеротромботический инсульт в бассейне средней мозговой артерии (ИИ);
-
ІI группа – с ЦА І–ІІ степени (без ИИ – группа сравнения).
В дальнейшем в сравнении групп участвовали пациенты
пожилого возраста – от 55 до 75 лет (табл. 1).
Дизайн исследования: простое проспективное нерандомизированное с последовательным включением пациентов. Исследование проводили на базе отдела сосудистой патологии головного мозга ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» и на базе консультативно-диагностического отделения ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины».
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с некорригируемым артериальным давлением (АД) > 160/90 мм рт.ст., другими нарушениями ритма, требующими проведения антиаритмической терапии, снижением ФВ < 40% по данным двухмерной эхокардиографии (ЭхоКГ), клинически выраженной сердечной недостаточностью, значительно выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. Также в исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца.
Также все пациенты проходили общепринятое клиническое, лабораторное и инструментальное исследование (ультразвуковая допплерография сосудов головы и шеи – исследование мозгового кровотока экстра- и интракраниальных отделов магистральных артерий головы и шеи на приборе Aplio XG (Toshiba), МРТ головного мозга). Все пациенты подписывали информированное согласие на участие в исследовании, которое было одобрено этическим комитетом ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» и ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины».
Больным проводили комплексное исследование, включающее дуплексное сканирование магистральных артерий головы и шеи без предварительной подготовки в положении пациента лежа на спине и сидя на приборе Aplio XG (Toshiba) линейным датчиком, работающим в частотном диапазоне 7,0–10,0 МГц.
Исследовались следующие гемодинамические параметры:
– линейная систолическая скорость кровотока (ЛССК),
– индекс пульсативности (PI),
– индекс периферического сопротивления (RI).
RI – индекс периферического сопротивления (индекс Пурсело) – косвенно характеризует состояние периферического сопротивления в исследуемом сосудистом бассейне. В артериях с низким периферическим сопротивлением он представляет собой отношение разности максимальной (пиковой) систолической и максимальной конечной диастолической скоростей к максимальной (пиковой) систолической скорости кровотока. Этот показатель отражает состояние сопротивления кровотоку дистальнее места измерения.
РI – индекс пульсативности (индекс Гослинга) – в артериях с низким периферическим сопротивлением представляет собой отношение разности максимальных систолической и диастолической скоростей кровотока к усредненной по времени максимальной скорости кровотока, отражает упруго-эластические свойства артерий и с возрастом, как правило, имеет тенденцию к снижению [7, 8].
При оценке состояния кровообращения в артериях Виллизиева круга с помощью транскраниального дуплексного сканирования учитывались следующие параметры:
– варианты анатомического строения артерий;
– частота окклюзирующих поражений артерий;
– функциональное состояние артерий и степень перестройки гемодинамики в артериях Виллизиева круга на стороне инфаркта и противоположной стороне.
Статистический анализ проводили с помощью непараметрических методов (критерий Манна–Уитни). Результаты представлены в виде медианы и 25%, 75% квартилей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Анализируемые группы были сопоставимы по возрасту, полу и уровням систолического АД (САД), диастолического АД (ДАД), пульсового АД (ПАД) (см. табл. 1).
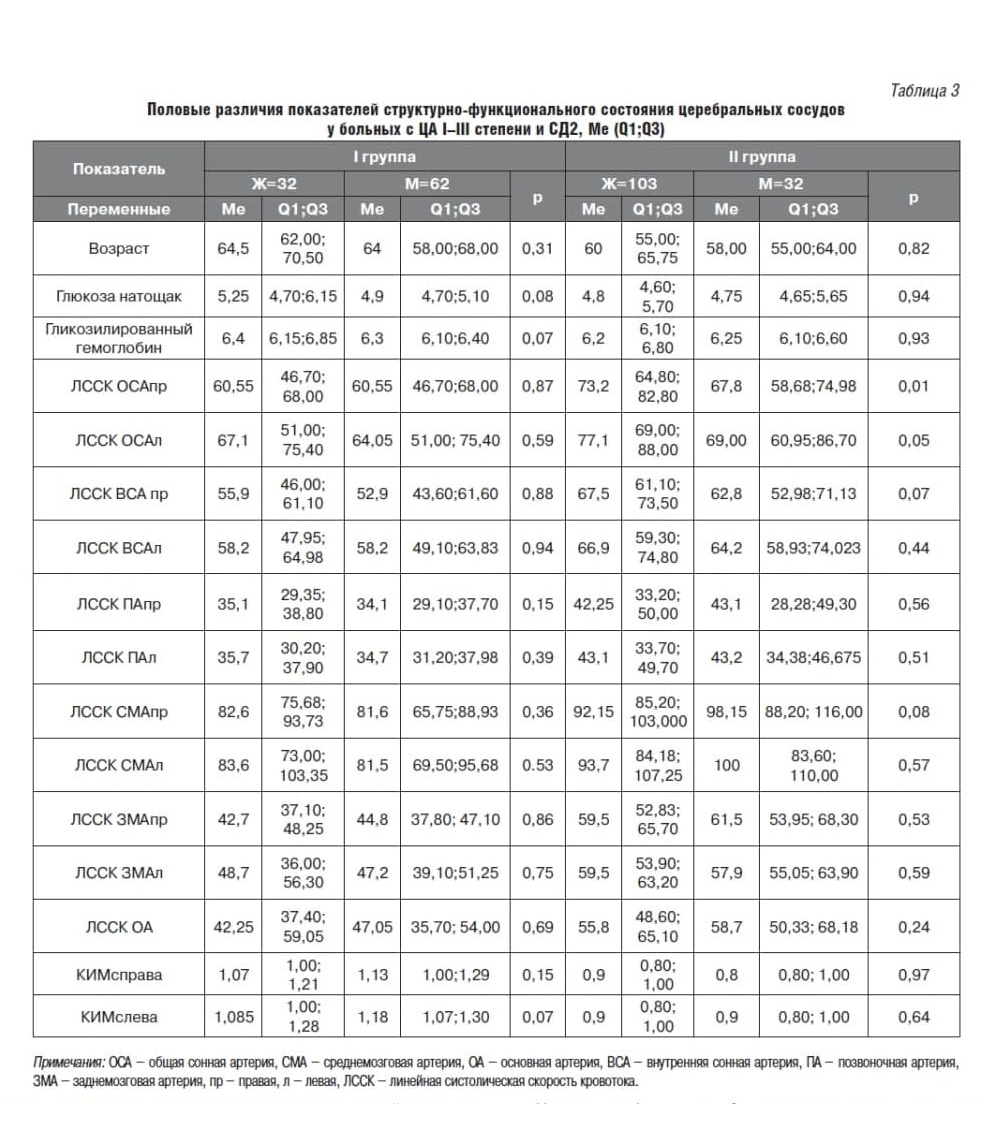
У пациентов I группы не было выявлено ни возрастных, ни половых различий в ЛССК сосудов каротидного и вертебро-базилярного бассейнов (табл. 2, табл. 3). У пациентов II группы старше 60 лет ЛССК в обеих ВСА была статистически значимо выше, чем у пациентов среднего возраста, при этом ЛССК в левых ПА, ЗМА и ОА – статистически значимо выше у пациентов среднего возраста, чем у пожилых (см. табл. 2).
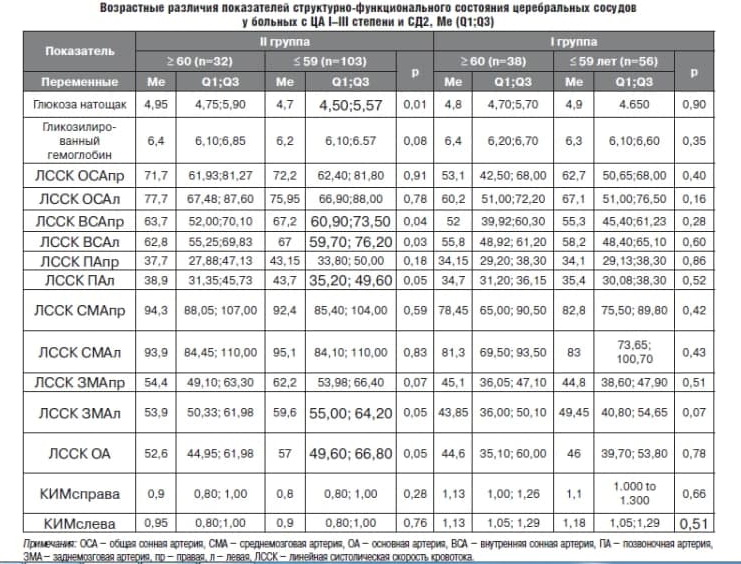
На наш взгляд, данные различия можно объяснить статистически значимыми различиями в уровне глюкозы крови натощак. Важно отметить, что статистически значимые половые различия были выявлены только для ЛССК в обеих ОСА: у женщин с ЦА I–II ст. скорость церебрального кровотока была выше, чем у мужчин (см. табл. 3).
ВЫВОДЫ
1. Для пациентов с ЦА III стадии и СД2 не установлены возрастные и половые различия в показателях мозгового кровообращения как в сосудах каротидного, так и в сосудах вертебро-базилярного бассейнов.
2. Для пациентов пожилого возраста с ЦА I–II стадии и СД2 по сравнению с пациентами среднего возраста характерно статистически значимо более высокая ЛССК в сосудах каротидного бассейна и более низкая в сосудах вертебро-базилярного бассейна.
3. Скорость мозгового кровотока пациентов женского пола с ЦА I–II стадии и СД статистически значимо выше в обеих общих сонных артериях в отличие от соответствующих показателей ЛССК у пациентов мужского пола.
СПИСОК ЛИТЕРАТУРЫ
-
Adla T, Adlova R. Multimodality imaging of carotid stenosis. Int J Angiol. 2014;24:179–184. doi: 10.1055/s-0035-1556056.
-
Benjamin EJ, Blaha MJ, Chiuve SE, Cushman M, Das SR, Deo R, et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 2017;135:e1–e458. doi: 10.1161/CIR.0000000000000485.
-
Canpolat U, Ozer N. Noninvasive cardiac imaging for the diagnosis of coronary artery disease in women. Anadolu Kardiyol Derg. 2014;14:741–746. doi: 10.5152/akd.2014.5406.
-
De Weerd M, Greving JP, Hedblad B, Lorenz MW, Mathiesen EB, O’Leary DH, et al. Prevalence of asymptomatic carotid artery stenosis in the general population: an individual participant data meta-analysis. Stroke. 2010;41:1294–1297. doi: 10.1161/STROKEAHA.110.581058.
-
Dowsley T, Al-Mallah M, Ananthasubramaniam K, Dwivedi G, McArdle B, Chow BJW. The role of noninvasive imaging in coronary artery disease detection, prognosis, and clinical decision making. Can J Cardiol. 2013;29:285–296. doi: 10.1016/j.cjca.2012.10.022.
-
Huibers A, De Borst GJ, Wan S, Kennedy F, Giannopoulos A, Moll FL, et al. Non-invasive carotid artery imaging to identify the vulnerable plaque: current status and future goals. Eur J Vasc Endovasc Surg. 2015;50:563–572. doi: 10.1016/j.ejvs.2015.06.113.
-
Jm W, Fm C, Jj B, Wartolowska K, Non-invasive BE. Review: noninvasive imaging techniques may be useful for diagnosing 70 % to 99 % carotid stenosis in symptomatic patients. Diagn ACP J Club. 2006;145:77.
-
Kristensen T, Hovind P, Iversen HK, Andersen UB. Screening with doppler ultrasound for carotid artery stenosis in patients with stroke or transient ischaemic attack. Clin Physiol Funct Imaging. 2018;38:617–621. doi: 10.1111/cpf.12456.
-
Lan W-C, Chen Y-H, Liu S-H. Non-invasive imaging modalities for the diagnosis of coronary artery disease: the present and the future. Tzu Chi Med J. 2013;25:206–212. doi: 10.1016/j.tcmj.2013.04.004.
-
Loizou CP. A review of ultrasound common carotid artery image and video segmentation techniques. Med Biol Eng Comput. 2014;52:1073–1093. doi: 10.1007/s11517-014-1203-5.
-
Menchón-Lara RM, Sancho-Gómez JL, Bueno-Crespo A. Early-stage atherosclerosis detection using deep learning over carotid ultrasound images. Appl Soft Comput J. 2016;49:616–628. doi: 10.1016/j.asoc.2016.08.055.
-
Naqvi TZ, Lee M-S. Carotid Intimamedia thickness and plaque in cardiovascular risk assessment. JACC Cardiovasc Imaging. 2014;7:1025–1038. doi: 10.1016/j.jcmg.2013.11.014.
-
Onanno LIB, Arino SIM, Ramanti PLB, Ottile FAS. Validation of a computer-aided diagnosis system for the automatic identification of carotid atherosclerosis. Ultrasound Med Biol. 2019;41:509–516.
-
Ovbiagele B, Goldstein LB, Higashida RT, Howard VJ, Johnston SC, Khavjou OA, et al. Forecasting the future of stroke in the united states: a policy statement from the American heart association and American stroke association. Stroke. 2013;44:2361–2375. doi: 10.1161/STR.0b013e31829734f2.
-
Ricotta JJ, Pagan J, Xenos M, Alemu Y, Einav S, Bluestein D. Cardiovascular disease management: the need for better diagnostics. Med Biol Eng Comput. 2008;46:1059–1068. doi: 10.1007/s11517-008-0416-x.
-
Saba L, Sanfilippo R, Sannia S, Anzidei M, Montisci R, Mallarini G, et al. Association between carotid artery plaque volume, composition, and ulceration: a retrospective assessment with MDCT. Am J Roentgenol. 2012;199:151–156. doi: 10.2214/AJR.11.6955.
-
Yamauchi K, Enomoto Y, Otani K, Egashira Y, Iwama T. Prediction of hyperperfusion phenomenon after carotid artery stenting and carotid angioplasty using quantitative DSA with cerebral circulation time imaging. J Neurointerv Surg. 2018;10:579–582. doi: 10.1136/neurintsurg-2017-013259.
-
Zhang X, Jie G, Yao X, Dai Z, Xu G, Cai Y, et al. DSA-based quantitative assessment of cerebral hypoperfusion in patients with asymmetric carotid stenosis. Mol Cell Biomech. 2019;16:27–39. doi: 10.32604/mcb.2019.06140.
-
Zhao S, Gao Z, Zhang H, Xie Y, Luo J, Ghista D, et al. Robust segmentation of intima-media borders with different morphologies and dynamics during the cardiac cycle. IEEE J Biomed Health Inform. 2018;22:1571–1582. doi: 10.1109/JBHI.2017.2776246.
-
Кузнецова С.М., Кузнецов В.В., Егорова М.С., Шульженко Д.В. Особенности церебральной гемодинамики у больных атеротромботическим и кардиоэмболическим ишемическим инсультом в восстановительный период. Международный неврологический журнал, 2011; №2 (40), 18–22.