Взаимосвязь между вариабельностью ритма и структурно-функциональным состоянием сердца у пациентов с церебральным атеросклерозом
Публикация обновлена: Июль 19
Клиническое значение вариабельности ритма сердца (ВРС) впервые оценили в 1965 году, когда E.H. Hon и S.T. Lee отметили, что развитию дистресса плода предшествует альтернация интервалов между сердечными сокращениями, возникающая до того, как произошли какие-либо видимые изменения собственно сердечного ритма [4]. Позднее B.M. Sayers и соавторы обратили внимание на присутствие физиологических ритмов в сигнале сердцебиения [6].
В клинических исследованиях показано, что реакции вегетативной нервной системы могут служить предикторами развития аритмий у больных с патологическими изменениями в сердце, например, при наличии дополнительных проводящих путей или при дилатации предсердий, ишемической болезни сердца (ИБС) и гипертрофии левого желудочка [7, 10, 15, 17]. Некоторые авторы предполагают, что дисфункция вегетативной регуляции сердечно-сосудистой системы (ССС) влияет на выживаемость после инсульта [1].
В настоящее время наиболее широко анализ ВРС применяется при различных вариантах кардиоваскулярной патологии, в частности, при остром инфаркте миокарда, хронической сердечной недостаточности, артериальной гипертензии, для стратификации риска внезапной смерти [1, 3–6, 10]. В мультицентровом исследовании ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) отмечено, что изменение ВРС имеет усугубляющее влияние при стратификации риска у постинфарктных больных и у пациентов с фракцией выброса (ФВ) левого желудочка ниже 35% [8]. Показано, что волновая структура ВРС в состоянии покоя зависит от возраста, пола, времени суток, уровня физической тренированности [9].
Изменение ритма сердца – это универсальная реакция целостного организма в ответ на воздействие внешней и внутренней среды, отражающая результат многочисленных регуляторных влияний на ССС. Иерархическая структура уровней регуляции включает нервный аппарат самого сердца, спинной мозг, ствол мозга, область гипоталамуса, кору головного мозга [2, 3, 7]. Полагают, что дисфункция вегетативной регуляции ССС влияет на выживаемость после инсульта, поэтому вопросы состояния вегетативного гомеостаза у больных с ишемическим инсультом (ИИ) также привлекают внимание исследователей [3, 6, 9, 11]. Вместе с тем исследования, отражающие динамику вегетативных изменений в острый период церебрального инсульта, на сегодня остаются единичными. Так, в проспективном шестимесячном наблюдении за пациентами с острым ИИ было выявлено снижение показателей ВРС в ответ на парасимпатические стимулы (по сравнению со здоровыми) в течение всего периода наблюдения, причем стволовая локализация сопровождалась более выраженными изменениями [6]. Авторы предполагали, что причиной данных изменений может быть повреждение кардиоингибиторных нейронов продолговатого мозга или нарушение связи с вышележащими модулирующими образованиями. Это соотносится с данными экспериментов на животных, где стимуляция кардиоингибиторных нейронов продолговатого мозга, гипоталамуса, коры островка провоцировала развитие брадикардии и артериальной гипотензии. У человека стимуляция коры правого островка связана с развитием тахикардии, а коры левого островка – с брадикардией [8].
Вегетативная дисфункция, проявляющаяся изменениями ВРС, при ишемическом поражении головного мозга имеет большое значение в прогнозировании исхода заболевания и оказывает влияние на течение постинсультного периода. Однако стоит отметить некоторую противоречивость полученных данных, а также наличие жестких критериев отбора пациентов для исследований, исключающих любые сопутствующие заболевания, оказывающих влияние на ВРС [3, 4, 6]. Это позволяет селективно выявлять изменения ВРС, зависящие непосредственно от инсульта. Однако у большинства пациентов с ишемическим поражением головного мозга диагностирована сопутствующая кардиальная патология, которая может влиять на течение постинсультного периода и выживаемость больных. Также необходимо отметить, что лишь в одной работе [6] изучали состояние очень низкочастотного компонента ВРС как показателя активности надсегментарных структур, тогда как в других работах [6, 9, 16] анализировали только параметры мощности в области высоко- и низкочастотного диапазонов. Это свидетельствует о необходимости дальнейшего изучения ВРС и роли поражения надсегментарных структур во взаимосвязи с особенностями церебрального и кардиального поражений.
Цель исследования:
выявление наличия взаимосвязей между показателями ВРС и структурно-функционального состояния сердца у пациентов с церебральным атеросклерозом (ЦА) 1–3-й степени в зависимости от полушарной локализации ишемического очага.
МАТЕРИАЛЫ И МЕТОДЫ
В комплексном клинико-инструментальном исследовании приняли участие 229 пациентов с ЦА 1–3-й степени.
Диагноз «Церебральный атеросклероз» формулировался в соответствии с классификацией атеросклероза Всемирной организации здравоохранения от 2015 года и подтверждался данными лабораторных и инструментальных исследований (ультразвуковая допплерография церебральных артерий, магнитно-резонансная томография (МРТ) головного мозга).
Пациенты были распределены на 4 группы:
І группа – перенесшие ишемический инсульт (ИИ) в правом полушарии (ПП);
ІІ группа – перенесшие ИИ в левом полушарии (ЛП);
ІІІ группа – с ЦА 1–2-й степени (без ИИ – группа сравнения);
ІV группа – общая группа пациентов, перенесших ишемический атеротромботический инсульт.
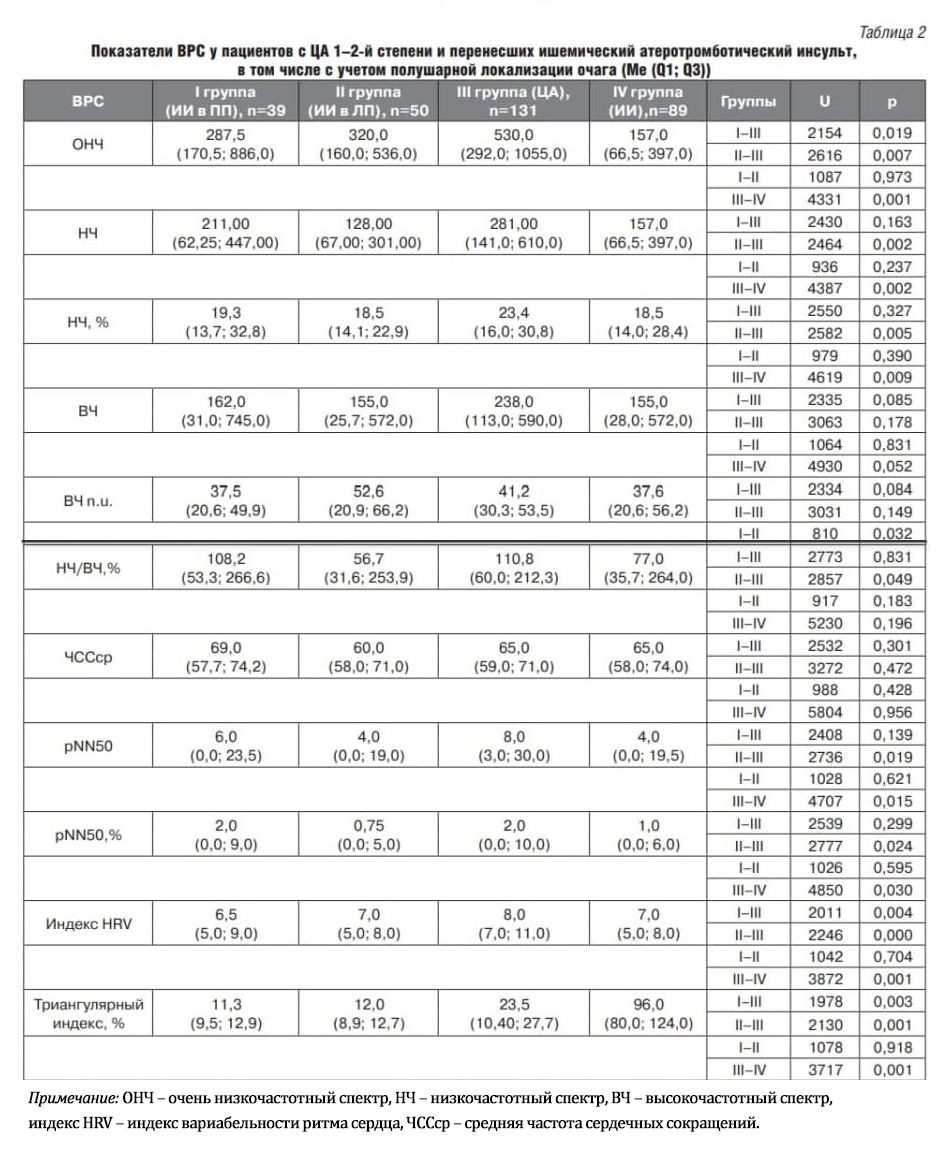
Возраст пациентов обследуемых групп составил от 55 до 75 лет (табл. 1).
Дизайн исследования: простое проспективное нерандомизированное, с последовательным включением пациентов. Проводилось на базе отдела сосудистой патологии головного мозга ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» (г. Киев).
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с неконтролируемой ГБ (АД) >160/90 мм рт.ст., нарушениями ритма, требующими проведения антиаритмической терапии, снижением ФВ<40% по данным двухмерной эхокардиографии (ЭхоКГ), сердечной недостаточностью (III, IV ФК по NYHA), выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. В исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца.
Все пациенты подписывали информированное согласие на участие в исследовании, которое было одобрено этическим комитетом ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» от 11 января 2016 г.
Все пациенты проходили общепринятое клиническое, лабораторное (общий анализ крови и мочи, определение липидного профиля, уровня креатинина, мочевины, глюкозы, аспартатаминотрансферазы, аланинаминотрансферазы, билирубина) и инструментальные исследования (трансторакальная ЭхоКГ, электрокардиография (ЭКГ), МРТ головного мозга).
Исследование ВРС проводили на аппарате Schiller AT-10 plus (Швейцария) с использованием статистического анализа временной области и спектрального анализа короткой (пятиминутной) последовательности электрокардиографических интервалов R–R в состоянии покоя. Определяли следующие показатели временного анализа: стандартное отклонение (SDnn, мс), стандартное отклонение разностей продолжительности соседних интервалов R–R (RMSSD, мс).
При выполнении спектрального анализа определяли: общую мощность спектра ритма сердца (tP, мс2 ), мощности в диапазоне 0,00–0,04 Гц (Vlf, мс2 ), 0,04–0,15 Гц (lf, мс2 ), 0,15– 0,4 Гц (hf, мс2 ) и соотношение lf/hf. Спектральные составляющие lf и hf анализировали как в абсолютных значениях, так и в производных от них нормализованных единицах (н.е.), которые автоматически рассчитывались по формулам: lfnorm = lf / (tP – Vlf) × 100% и hfnorm = hf / (tP – Vlf) × 100%. Определяли также структуру спектра в процентном соотношении составляющих: %Vlf, %lf, %hf.
Эхокардиографические исследования проведены на аппарате «Aplio 300» («Toshiba», Япония) с использованием фазированного датчика PST-30BT 3 МГц в соответствии с рекомендациями Европейского кардиологического общества. Определяли: конечно-систолический размер (КСР), конечнодиастолический размер (КДР), конечно-систолический и конечно-диастолический объемы сердца (КСО, КДО), размер ЛП, правого желудочка (ПЖ), толщину межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ). Рассчитывались индексы ЛП (иЛП) КСО и КДО (иКСО, иКДО), а также КСР и КДР (иКСР, ИКДР), фракция выброса ЛЖ (ФВ), ударный объем (УО), масса миокарда ЛЖ (ММЛЖ) и индекс ММЛЖ (иММЛЖ).
Для оценки геометрии ЛЖ рассчитывали индекс относительной толщины стенок ЛЖ (иОТСЛЖ) с последующим выделением нормальной геометрии, концентрического ремоделирования, концентрической и эксцентрической гипертрофии [8]. Диастолическую функцию ЛЖ оценивали по максимальной скорости раннего (Е) и позднего (А) наполнения ЛЖ и их соотношения (Е/А), времени замедления скорости раннего диастолического наполнения ЛЖ (DT) и времени изоволюметрического расслабления миокарда ЛЖ (IVRT). Рассчитывали отношение пика Е к пику Е’, скорости движения фиброзного кольца митрального клапана (латеральной или медиальной его частей) – E/Е’. Увеличение E/Е’>8 усл. ед. отражает повышение давления наполнения ЛЖ, значения >15 усл. ед. рассматривается как маркер диастолической дисфункции [9]. Нами использована следующая классификация типов диастолической дисфункции ЛЖ: E/A≤0,8 E/Е’≤8, DT>200 мс – I ст.; E/A – 0,8–1,5 E/Е’ – 9–12, DT – 160– 200 мс – IІ ст.; E/A>2, E/Е’>12, DT<160 мс – III ст. [10].
Статистический анализ проводили с помощью непараметрических методов (критерий Манна–Уитни, коэффициент ранговой корреляции Спирмена). Результаты представлены в виде медианы и 25%, 75% квартилей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Согласно данным табл. 2, группа сравнения (ЦА 1–2-й степени), также как и группа пациентов с ИИ и ИИ в ПП, характеризуется преобладанием в спектре волн очень низкой частоты с соотношением составляющих спектра: VLF > LF > HF, что свидетельствует о снижении активности сегментарных механизмов регуляции, тогда как в группе ИИ в ЛП наблюдается несколько иное соотношение спектров VLF > HF > LF, что указывает на напряженное вегетативное равновесие с незначительной активацией эрготропных влияний у данной категории пациентов.
Анализ результатов показал, что пациенты, перенесшие ИИ и ИИ в ПП и ЛП, имеют более низкие значения показателей области очень низких частот и высоких частот по сравнению с группой пациентов с ЦА 1–2-й степени, что указывает на угнетение активности сегментарных систем, преимущественно за счет парасимпатического отдела у пациентов в постинсультный период вне зависимости от полушарной локализации очага. Однако, учитывая наличие статистически значимых отличий между группами ЛП и ПП постинсультных пациентов величин показателей очень низкочастотного и низкочастотного спектров, следует отметить, что степень выраженности угнетения симпатического отдела нервной системы у правополушарных пациентов значимо выше.
При анализе временных составляющих спектра ВРС было установлено статистически значимое снижение доли и величины показателя pNN50, отражающего парасимпатическую активность, у пациентов в общей группе ИИ и с очагом в ЛП по сравнению с группой ЦА 1–2-й степени, что в некоторых исследованиях ассоциируется с неблагоприятным прогнозом и находится в тесной взаимосвязи с патогенезом желудочковых аритмий и внезапной смерти.
У исследуемых нами пациентов с ИИ величина триангулярного индекса, во-первых, была ниже 25 ед. (норма = 37). Во-вторых, cтатистически значимые отличия наблюдались у всех пациентов, перенесших ИИ с ЦА 1–2-й степени. Так, у пациентов, перенесших ИИ и в ПП, и в ЛП, триангулярный индекс практически в 2 раза был ниже, чем у пациентов с ЦА. Прогностическая значимость триангулярного индекса подтверждена во многих исследованиях [13, 15, 17]. Например, в исследовании Т. Griррs и соавторов (1991) установлена прогностически неблагоприятная величина триангулярного индекса – 25 ед. и менее. Чувствительность в оценке неблагоприятных исходов, связанных с аритмией, составила 87%, специфичность – 56%, предсказывающая ценность положительного результата – 15%, предсказывающая ценность отрицательного результата – 98%. Показатель превосходит параметр SDNN с точки зрения предсказывающей ценности в выявлении экстрасистол высоких градаций, «пробежек», неустойчивой желудочковой тахикардии, снижения сократительной способности левого желудочка.
Для выявления взаимосвязей между показателями структурно-функционального состояния сердца и ВРС был проведен корреляционный анализ с расчетом коэффициента ранговой корреляции Спирмена. Так, в общей группе пациентов, перенесших ИИ, установлена одна обратная корреляционная связь между показателями индекса массы миокарда левого желудочка (иММЛЖ) и НЧ/ВЧ% (r=-0,298), а в группе пациентов без ИИ с ЦА 1–2-й степени установлены связи индекса относительной толщины стенки ЛЖ (ИОТСЛЖ) с индексами HRVи НЧ/ВЧ (r=-0,196 и r=0,183 соответственно) и две связи показателя диастолической функции миокарда ЛЖ с HRV и триангулярным индексом (r=0,202 и r=0,217 соответственно) (табл. 3, 4).
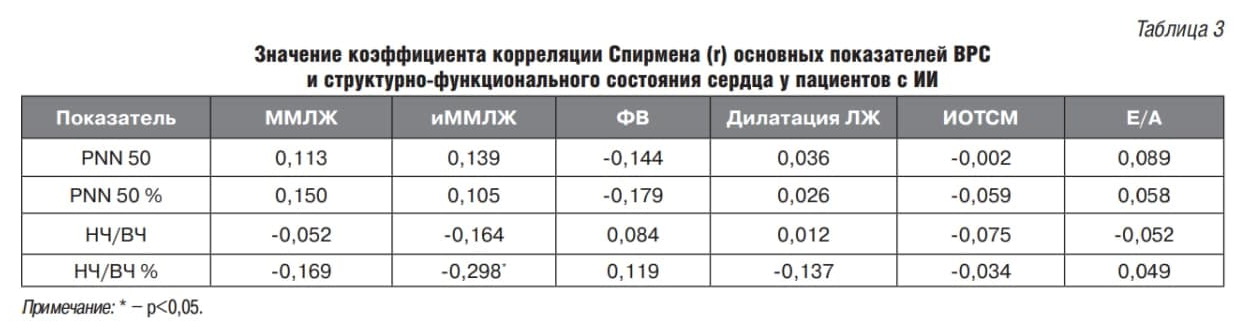
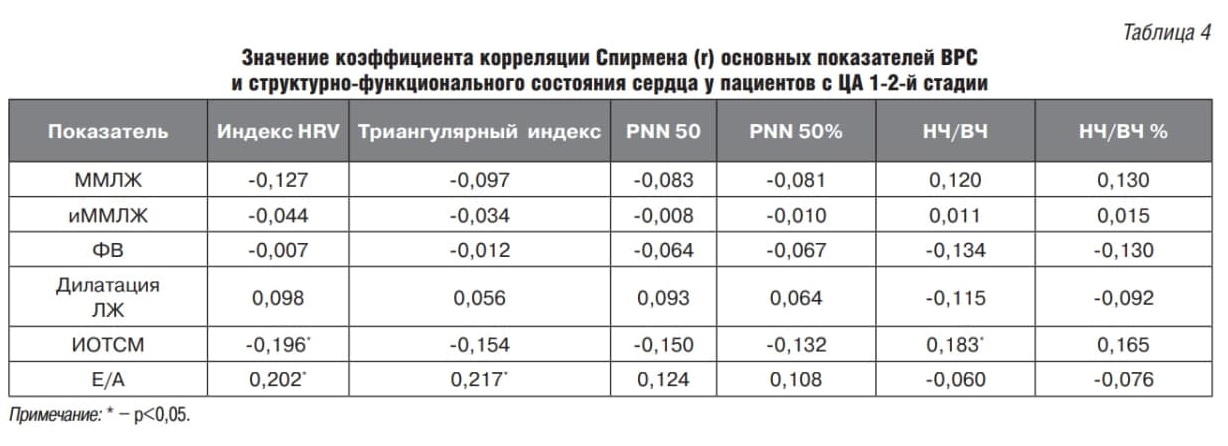
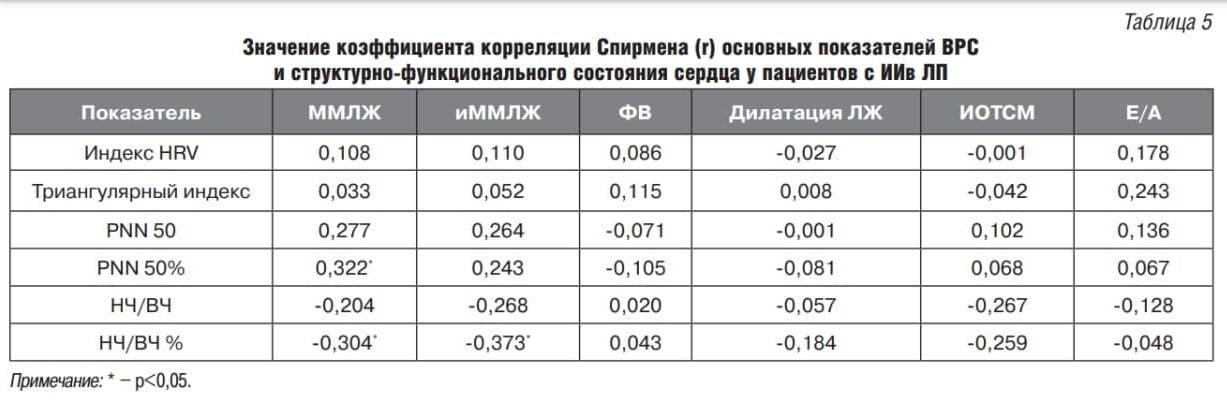
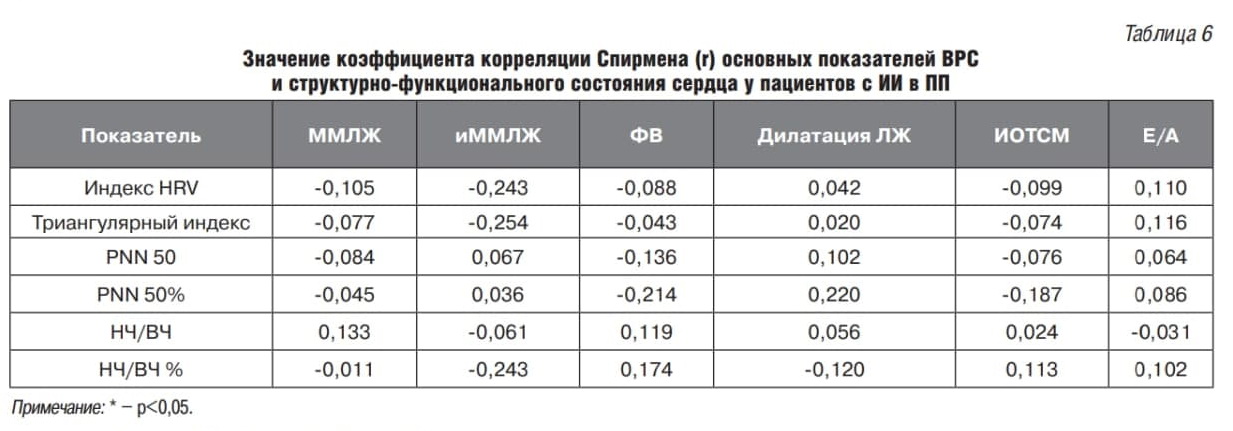
При сравнении групп пациентов с разной локализацией ИО было установлено, что для пациентов с ИО в ЛП характерно наличие трех связей ММЛЖ и иММЛЖ с PNN50% и НЧ/ВЧ% (0,322, -0,304 и -0,373 соответственно), тогда как у пациентов с локализацией ИО в ПП связей установлено не было (табл. 5, 6).
ВЫВОДЫ
1. Для постинсультных пациентов с церебральным атеросклерозом характерно выраженные нарушения вариабельности ритма сердца (ВРС), свидетельствующие об угнетении парасимпатической и активации симпатической нервной системы, что может иметь неблагоприятную предсказывающую ценность с точки зрения формирования желудочковой аритмии и внезапной сердечной смерти.
2. Дисфункция вегетативной регуляции сердечно-сосудистой системы зависит от полушарной локализации очага ишемического инсульта: наиболее выраженные изменения присущи больным, перенесшим мозговую катастрофу в левом полушарии головного мозга, могут детерминировать более неблагоприятный прогноз.
3. У больных с церебральным атеросклерозом без ишемического инсульта снижение ВСР с активацией симпатической нервной системы связано с концентрическим ремоделированием левого желудочка (ЛЖ) и более выраженной диастолической дисфункцией ЛЖ. Наличие ишемического очага в левом полушарии головного мозга, в отличие от правого полушария, определяет более выраженные изменения ВСР у больных по мере увеличения степени гипертрофии ЛЖ, что определяет высокий риск развития повторных сосудистых событий.
СПИСОК ЛИТЕРАТУРЫ
1. Гончар И.А. Состояние вариабельности сердечного ритма у больных с прогрессирующим атеротромботическим инфарктом мозга / Дальневосточный медицинский журнал. – 2011;2:12–15. Gontschar IA.
2. Долгов А.М. Цереброкардиальный синдром при ишемическом инсульте (часть 1) / Вестник интенсивной терапии. – 1994; 2:10–14.
3. Рябыкина Г.В., Соболев А.В. Вариабельность ритма сердца. – М., 1998. – 196 с.
4. Рябыкина Г.В., Соболев А.В. Холтеровское и бифункциональное мониторирование ЭКГ и артериального давления. – М., 2010. – 320 с.
5. Самохвалова Е.В., Гераскина Л.А., Фонякин А.В. Инфаркты мозга в каротидной системе и вариабельность сердечного ритма в зависимости от поражения островковой доли / Неврологический журнал. – 2009:4;10–15.
6. Трунова Е.С. Состояние сердца и течение острого периода ишемического инсульта [диссертация]. – М., 2008. – 142 с.
7. Фонякин А.В., Гераскина Л.А., Домашенко М.А. Вариабельность сердечного ритма при ишемическом инсульте / Вестник аритмологии. – 2004; 35 (Приложение от 28.05.2004):95.
8. Фонякин А.В., Гераскина Л.А., Трунова Е.С., Самохвалова Е.В. Изменения циркадного индекса частоты сердечных сокращений в остром периоде ишемического инсульта в зависимости от особенностей очагового церебрального поражения/ Функциональная диагностика. – 2007;1:41–42.
9. Chen C.F., Lai C.L., Lin H.F., Liou L.M., Lin R.T. Reappraisal of heart rate variability in acute ischemic stroke. Kaohsiung J Med Sci. 2011;27(6):215–21. https:// doi.org/10.1016/j.kjms.2010.12.014
10. Dütsch M., Burger C., Dörfler S., Schwab M.J., Hilz M.J. Cardiovascular autonomic function in poststroke patients. Neurology. 2007; 69(24):2249–55
11. Fracica J.V., Bigongiari A., Mochizuki L., Scapini K.B., Moraes OA, Mostarda C, Caperuto EC, Irigoyen MC, De Angelis K, Rodrigues B. Cardiac autonomic dysfunction in chronic stroke women is attenuated after submaximal exercise test, as evaluated by linear and nonlinear analysis. BMC Cardiovasc Disord. 2015;15:105. https://doi. org/10.1186/s12872-015-0099-9
12. Fyfe-Johnson A.L., Muller C.J., Alonso A., Folsom A.R., Gottesman RF, Rosamond WD, Whitsel EA, Agarwal SK, MacLehose RF. Heart Rate Variability and Incident Stroke: The Atherosclerosis Risk in Communities Study. Stroke. 2016;47(6):14528. https://doi. org/10.1161/STROKEAHA.116.012662.
13. Grilletti J.V.F, Scapini K.B., Bernardes N., Spadari J, Bigongiari A, Mazuchi FAES, Caperuto EC, Sanches IC, Rodrigues B, De Angelis K. Impaired baroreflex sensitivity and increased systolic blood pressure variability in chronic post-ischemic stroke. Clinics (Sao Paulo). 2018;73:e253. https://doi.org/10.6061/ clinics/ 2018/ e253
14. Kwon D.Y., Lim H.E., Park M.H., Oh K, Yu SW, Park KW, Seo WK. Carotid atherosclerosis and heart rate variability in ischemic stroke. Clin. Auton. Res. 2008;18(6):355–7. https://doi. org/10.1007/s10286-008-0502-z.
15. Utriainen K.T., Airaksinen J.K., Polo O.J., Scheinin H, Laitio RM, Leino KA, Vahlberg TJ, Kuusela TA, Laitio TT. Alterations in heart rate variability in patients with peripheral arterial disease requiring surgical revascularization have limited association with postoperative major adverse cardiovascular and cerebrovascular events. PLoS One. 2018;13(9): e0203519. https://doi.org/10.1371/journal. pone.0203519.
16. Lees T., Shad-Kaneez F., Simpson A.M., Nassif N.T., Lin Y, Lal S. Heart Rate Variability as a Biomarker for Predicting Stroke, Post-stroke Complications and Functionality. Biomark Insights, 2018;13:1177271918786931. https:// doi.org/10.1177/1177271918786931
17. Xu Y.H., Wang X.D., Yang J.J., Zhou L, Pan YC. Changes of deceleration and acceleration capacity of heart rate in patients with acute hemispheric ischemic stroke. Clin Interviewee’s Aging. 2016;11:2938. https://doi.org/10.2147/CIA.S99542